Structure et propriétés de la matière
I - Rappels : Les molécules et leur représentation⚓︎
Ci-dessus, la représentation de la molécule d'aspirine.
En noir, les atomes de carbone ; en rouge, les atomes d'oxygène et en blanc les atomes d'hydrogène.
On remarque également que les "traits" représentant des liaisons covalentes entre les atomes sont plus ou moins épais : il s'agit de laisons simples ou de liaisons doubles.
Vous pouvez faire tourner la molécule sur elle-même en cliquant dessus et zoomer en utilisant la molette de la souris.
(désolé, le tactile n'est pas pris en charge !)
1) Les représentations⚓︎
a. formule brute⚓︎
La formule brute d'une molécule indique la nature des atomes qui la constituent et le nombre de chacun de ces atomes. Ce nombre est précisé en indice, droite du symbole de ces atomes.
Exemple : La molécule d'aspirine ci-dessus comporte 9 atomes de carbones, 4 atomes d'oxygène et 8 atomes d'hydrogène. Sa formule brute est donc C9H8O4.
b. Les liaisons covalentes⚓︎
Elles correspondent à la mise en commun par deux atomes de deux électrons, chaque atome fournissant un électron.
Elle est schématisée par un trait :
Exemple :Deux atomes d'hydrogène vont mettre en commun leur électron pour créer une liaison covalente et former ainsi une molécule de dihydrogène H2 :
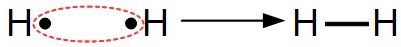
De même deux atomes d'oxygène mettront chacun deux électrons en commun pour former du dioxygène O2 :

c. Formules développée et semi-développée⚓︎
Dans la formule développée, toutes les liaisons entre les différents atomes apparaissent.
Exemples :
le dioxyde de carbone CO2 : 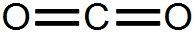
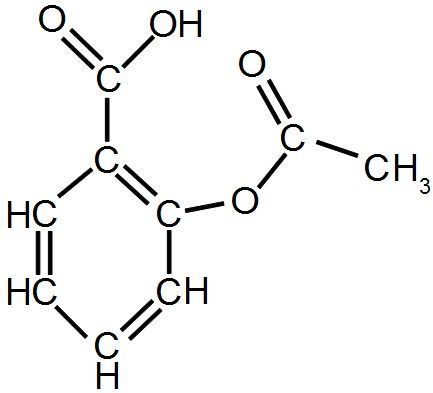
l'aspirine C9H8O4 :
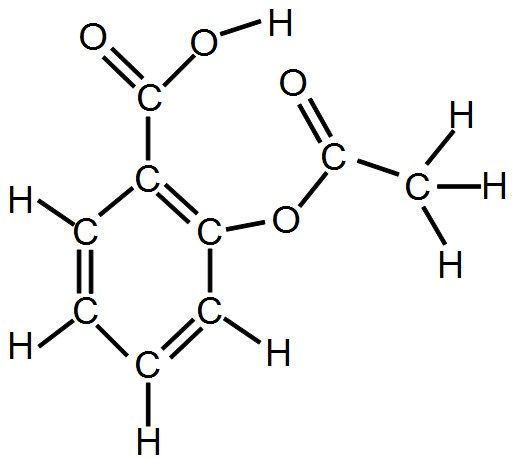
Dans la formule semi-développée, les liaisons avec les atomes d'hydrogène ne sont pas représentées.
Exemple : l'aspirine devient
2) La représentation de Lewis⚓︎
Grâce à cette représentation, il est possible de prévoir combien de liaisons covalentes chaque atome est capable de former.
En effet, les atomes vont essayer de se rapprocher de la structure du gaz noble le plus proche en mettant en commun les électrons de leur couche externe (les couches internes ne comptent pas).
Application au dichlorométhane
La molécule de dichlorométhane a pour formule brute CH2Cl2
- Je fais la liste de tous les atomes présents dans la molécule :
Carbone C, hydrogène H, chlore Cl. - J'écris la structure électronique de chaque atome :
- Carbone : 1s22s2 2p2
- Hydrogène : 1s1
- Chlore : 1s22s22p63s23p5
- Je cherche le nombre de liaisons covalentes que l'atome doit établir pour se rapprocher de la structure du gaz noble le plus proche : il correspond au nombre d'électrons à acquérir
- Carbone : il lui manque 4 électrons pour atteindre 2p6, il formera 4 liaisons covalentes
- Hydrogène : il lui manque 1 électron pour atteindre 1s2, il ne formera qu'une liaison covalente
- Chlore : il lui manque 1 électron pour atteindre 3p6, il ne formera qu'une liaison covalente
-
Je représente tous les atomes avec les points qui représentent leurs électrons externes 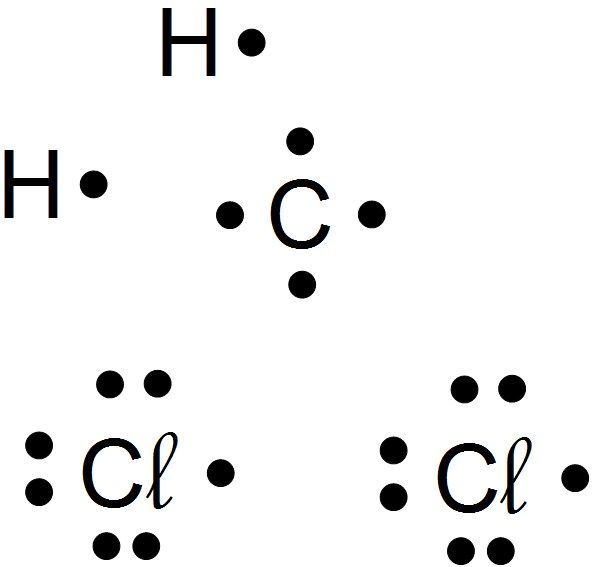
-
Je place les liaisons covalentes de façon à ce que tous les atomes en aient le bon nombre que qu'ils soient liés entre eux 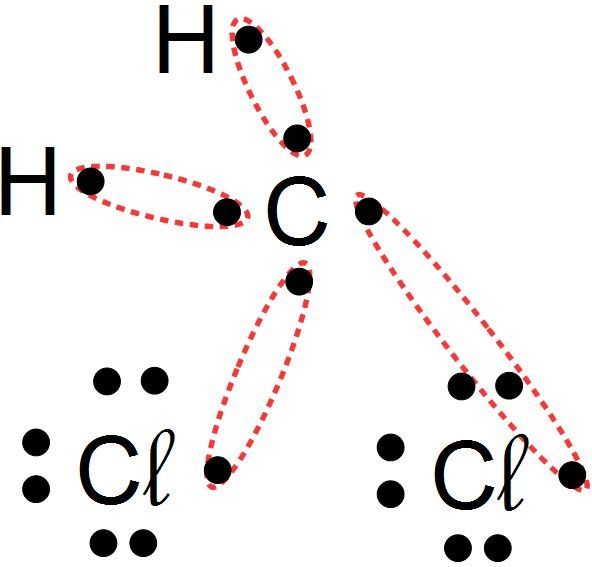
-
Finalement, je représente la formule brute : 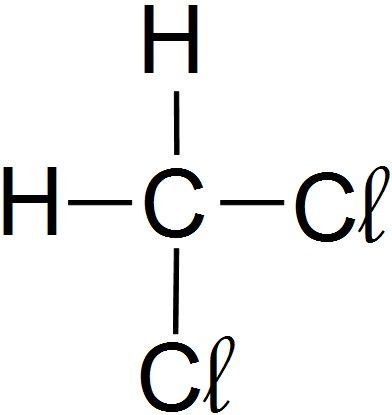
Remarque
Il est possible que 2 molécules aux structures différentes partagent la même formule brutes : elles sont isomères l'une de l'autre.
II - Electronégativité⚓︎
Définition
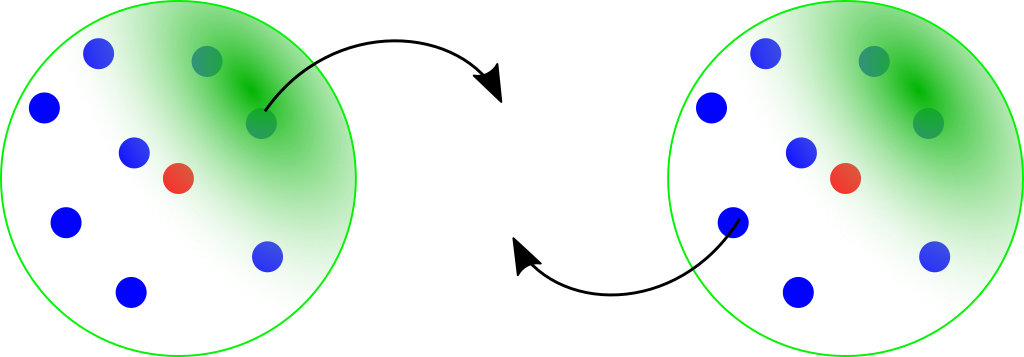
De façon à satisfaire la règle du duet ou de l'octet en se rapprochant de la structure électronique du gaz noble le plus proche, deux atomes vont mettre chacun en commun un électron de leur couche externe et former une liaison covalente.
A savoir
Les atomes les plus électronégatifs seront :
- les halogènes à qui il ne manque qu'un seul électron sur la couche externe pour atteindre la configuration du gaz noble le plus proche
- Ceux dont les électrons seront le plus proche du noyau pour bénéficier de l'attraction des protons (L > M > N).
III - Les différents types de liaisons⚓︎
1) Liaison polaire⚓︎
Définition
décalage du centre de la liaison
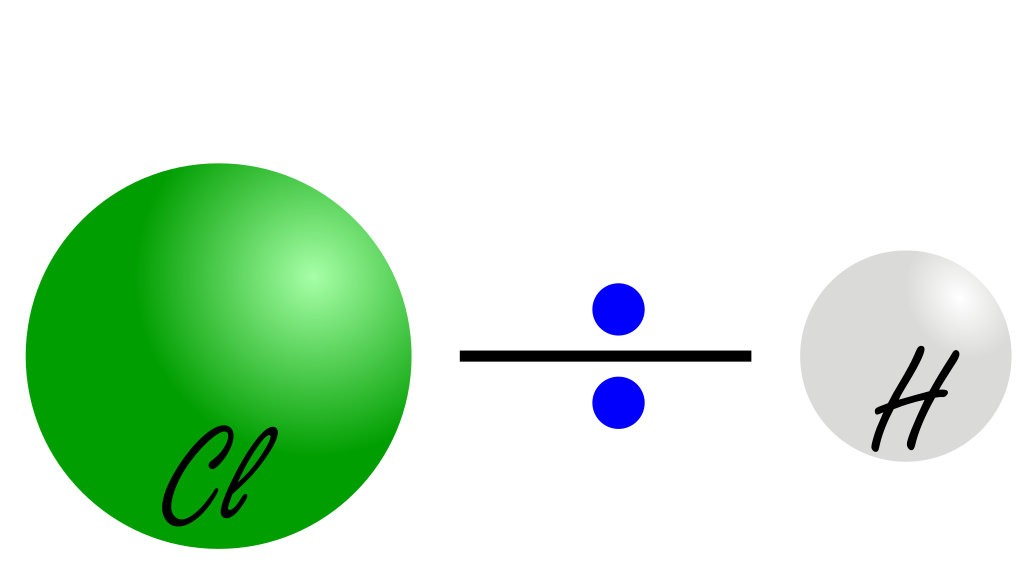
Si deux atomes ayant des électronégativités différentes forment une liaison covalente (comme par exemple le chlore et l'hydrogène pour la molécule de chlorure d'hydrogène), l'atome le plus électronégatif aura tendance à attirer à lui plus fortement le couple d'électrons de la lisaison.
Ce déplacement des électrons vers l'atome de chlore crée un déséquilibre dans les charges : l'atome de chlore semble chargé négativement (-δ) et l'atome d'hydrogène positivement (+δ).
On parle dès lors de liaison polaire. Le symbole δ représente l'excès de charge apparente et vaut une fraction de la charge d'un électron : 0 ≤ δ ≤ 1,6×10-19C.
conséquence
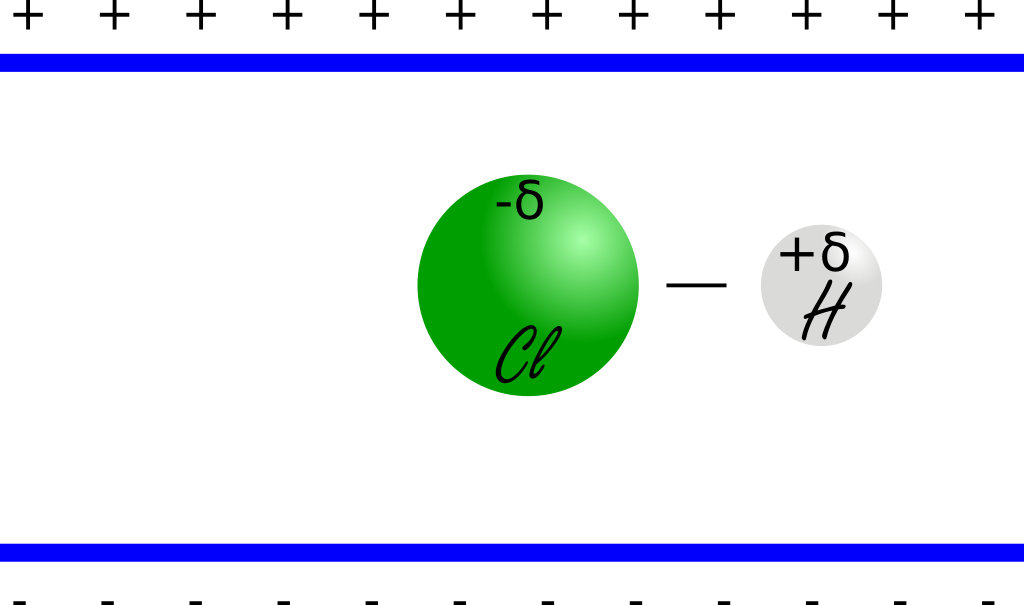
Si une molécule polaire se trouve dans un champ électrique , l'atome portant une charge +δ sera attiré dans un sens alors que l'autre atome sera attiré dans l'autre.
Cela aura pour effet de faire tourner la molécule de façon à ce que l'axe de la liaison covalente s'aligne avec la direction du champ électrique.
2) Polarité d'une molécule⚓︎
A savoir
Une molécule est dite polaire si le (bary)centre des différentes charges positivesportées par les atomes n'est pas confondu avec le (bary)centre des différentes charges négatives.
Au contraire si les deux (bary)centres sont confondus, la molécule est "globalement" apolaire.
2 exemples
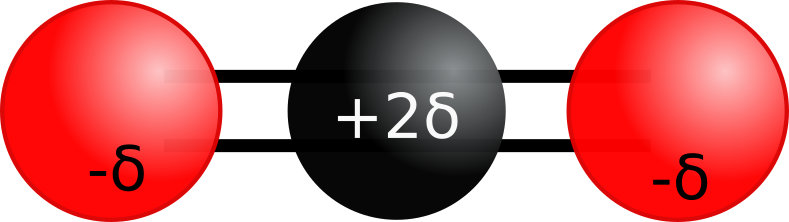
La molécule de CO2 est apolaire car le (bary)centre des charges négatives portées par les atomes d'oxygène est situé au milieu de l'atome de carbone, confondu avec la charge positive portée par celui-ci.
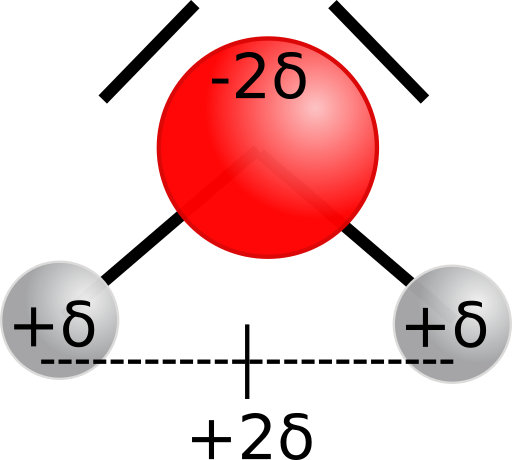
La molécule d'eau d'H2O est polaire car le (bary)centre des charges positives portées par les atomes d'hydrogène n'est pas situé au milieu de l'atome d'oxygène, porteur de la charge négative.
Attention
Bien que les représentations que nous pouvons faire sur le papier soient 2D, il ne faut pas oublier que la plupart des molécules ne sont pas planes et que leur représentation en 2D peut porter à confusion quant à la détermination de leur polarité !
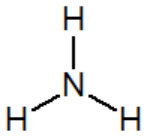
Représentation de l'ammoniac NH3 : la molécule semble apolaire...
La molécule a en fait une structure pyramidale : l'atome d'azote n'est pas dans le plan formé par les 3 atomes d'hydrogène : la molécule est polaire.
3) Liaison ionique⚓︎
un cas extrême
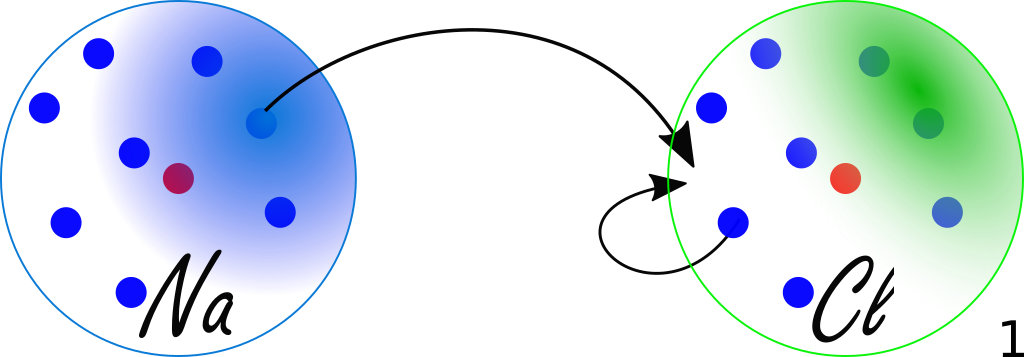
Si les deux atomes ont des électronégativités trop différentes (ci-contre : le chlore et le sodium), alors l'atome le plus électronégatif (ici, le chlore) va pratiquement arracher l'électron de l'atome le moins électronégatif (ici, le sodium).
La liaison ne sera plus polarisée, elle sera ionique : deux ions seront côte à côte (ici, Na+ et Cl-), simplement attirés par la force électrostatique du fait de leurs charges électriques opposées.
Cristal ionique
Comme les anions (chargés négativement) et les cations (chargés positivement) s'attirent mutuellement alors que les cations entre eux et les anions entre eux se repoussent, les ions en présence vont spontanément s'organiser de façon à minimiser les répulsions et maximiser les attractions.
Cela va donner naissance à une organisation ordonnée de ces ions dans l'espace.
4) Liaison hydrogène⚓︎
A savoir
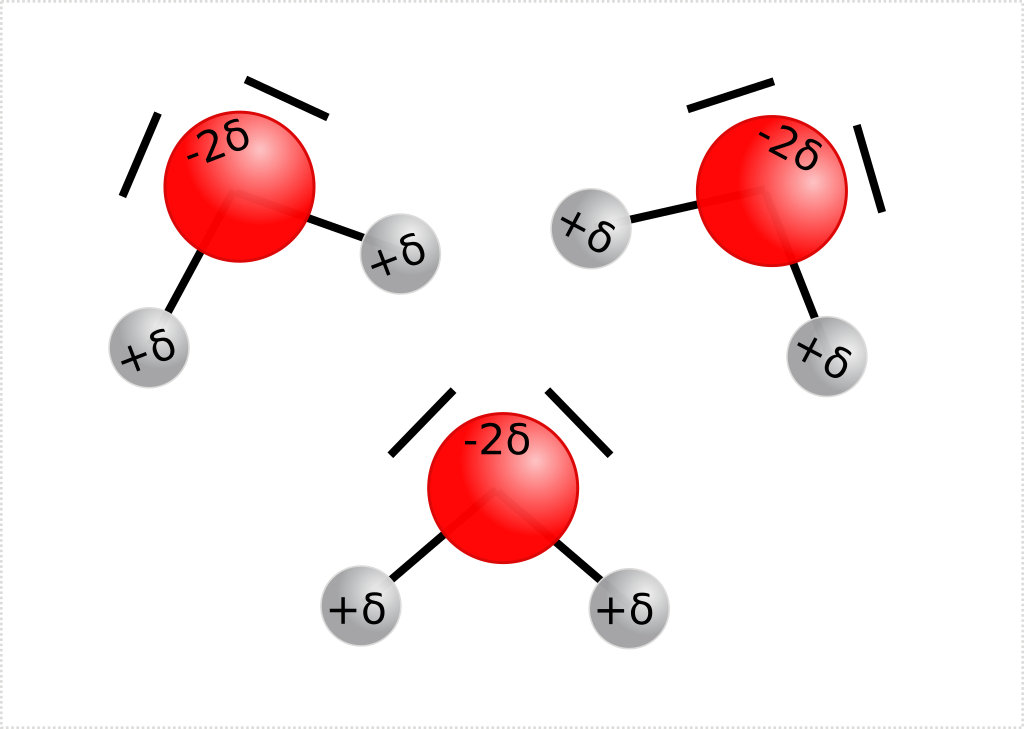
Si un atome d'hydrogène est lié par une liaison covalente à un atome très électronégatif (azote, chlore, oxygène ou fluor), il va lui être possible d'établir une liaison hydrogène avec un autre atome très électronégatif.
Cette liaison est une intensité moindre que la liaison covalente et elle varie d'ailleurs fortement en fonction du type de molécule qui l'héberge.
Cette liaison peut orienter la molécule. Elle est représentée par des pointillés et les 3 atomes concernés (les deux atomes très électronégatif et l'hydrogène au milieu) vont se retrouver alignés (pour minimiser les répulsion électrostatiques, comme dans le cas d'une liaison ionique).
Conséquence
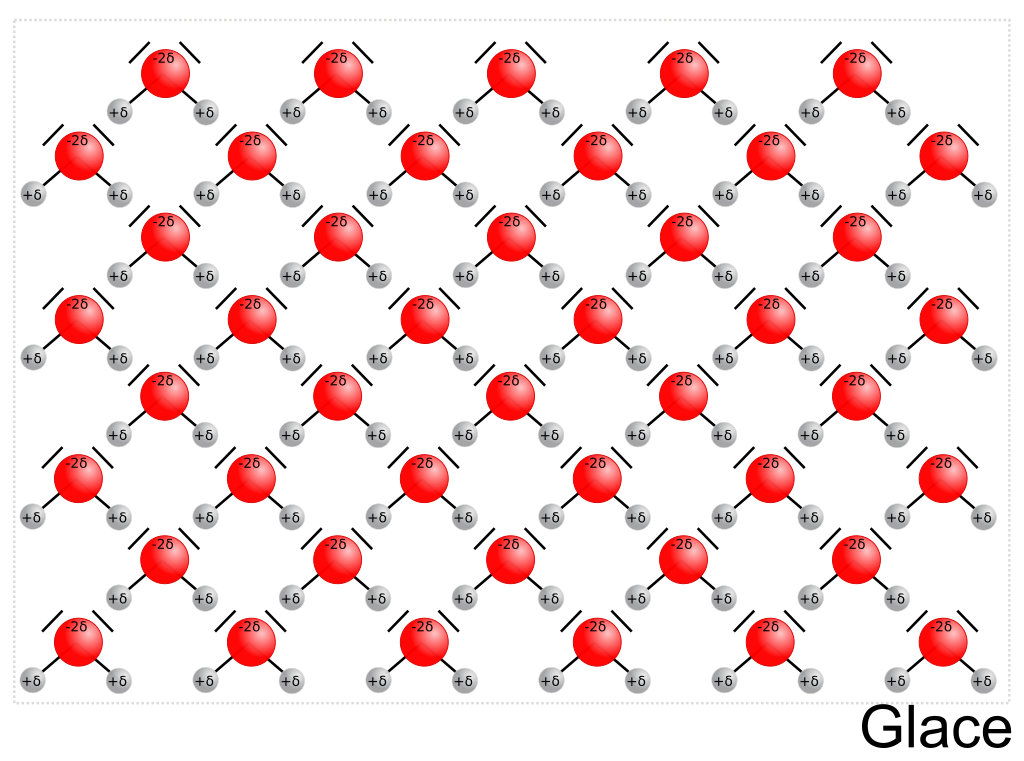
La liaison hydrogène explique une particularité très rare de l'eau : la glace est moins dense que l'eau liquide alors que pour l'écrasante majorité des substances chimiques, c'est l'inverse !
Lorsque l'agitation moléculaire n'est plus suffisante (la température est suffisamment basse), les liaisons hydrogène arrangent les molécules d'eau entre elles en laissant davantage d'espace.
5) Liaisons de van der Waals⚓︎
Définition
Les liaisons de Van der Waals sont un autre type de liaisons électrostatique, mais plus faibles que les liaisons hydrogène.
Elles proviennent d'interactions électrostatiques entre les nuages électroniques des différentes molécules en présence. Elles sont d'autant plus intenses que les liaisons dans les molécules sont polaires et rapprochées.
En pratique
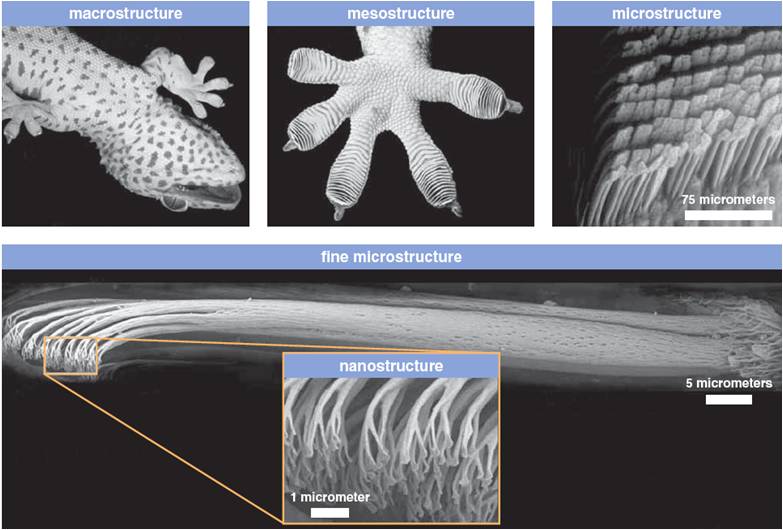
Les interactions de Van der Waals assurent la cohésion des solides moléculaires (le sucre par exemple) dont la solidité ne peut s'expliquer ni par des liaisons ioniques, ni totalement par des liaisons hydrogène.
Elles expliquent également la capacité du gecko à grimper sur des surfaces lisses, alors qu'il n'a pas de ventouses au bout des pattes : elles contiennent au contraire un très grand nombre de petits poils très fins assurant une liaison de Van der Waals d'une intensité suffisante pour porter son poids.
Pour en savoir plus : lien vers cultursciences.chimie.ens.fr
IV - Interactions entre molécules⚓︎
1) Dissolution d'un solide ionique⚓︎
Solvatation
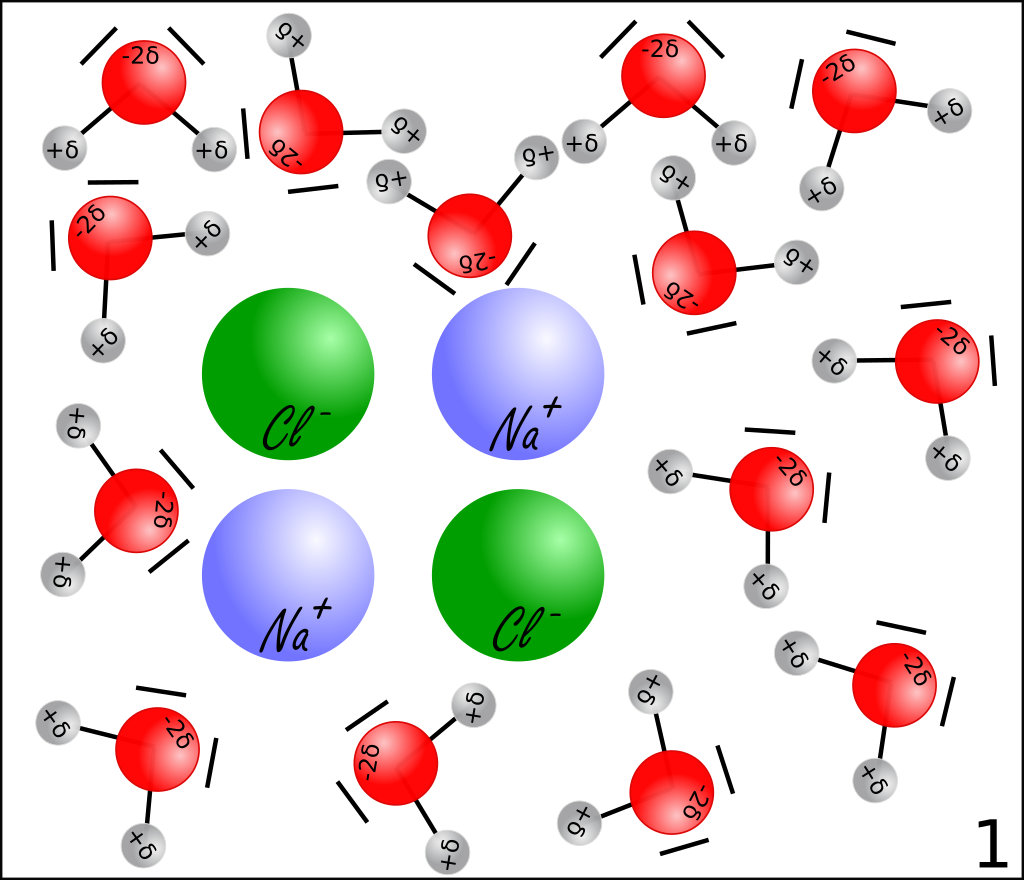
La dissolution d'un solide ionique par un solvant polaire se déroule en 3 temps :
- les molécules du solvant"cassent" les liaisons ioniques en s'intercalant entre les ions,
- elles entourent les ions en fonction de leur polarité : c'est la solvatation,
- enfin, les ions entourés des molécules de solvant se dispersent dans la solution.
2) Miscibilité et solubilité⚓︎
Rappel :
Deux liquides sont miscibles si leur mélange forme une seule phase homogène.
Une substance liquide est soluble dans un solvant s'il est possible de la dissoudre dans ce solvant.
A savoir
Les solvants polaires vont avoir tendance à bien dissoudre les solides ioniques et les molécules polaires tandis que les solvants apolaires fonctionneront mieux avec les molécules apolaires.
De même pour la miscibilité des liquides polaires et apolaires.
De plus, la possibilité de former des liaisons hydrogène va également augmenter la solutbilité de la molécule.
Exemple
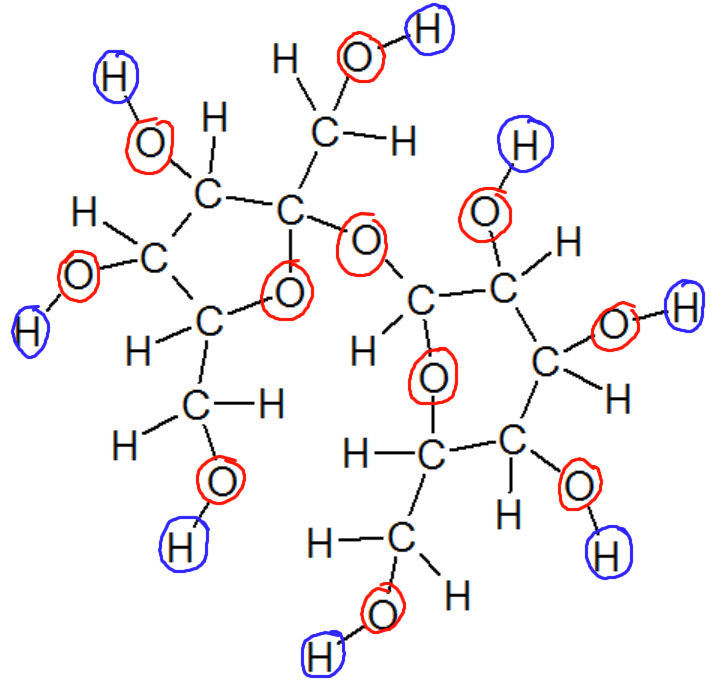
La molécule de saccharose qui compose le sucre que l'on consomme habituellement n'est pas un solide ionique. Il est pourtant très soluble dans l'eau : la molécule contient un grand nombre d'oxygènes garantissant des zones chargées négativement ainsi que des hydrogènes qui y sont liés, permettant d'envisager non seulement la polarité de la solution mais également l'établissement de liaisons hydrogène probablement à l'origine de l'aspect sirupeux d'un mélange très sucré.
V - Nomenclature⚓︎
1) Le squelette carbonné⚓︎
Une molécule organique est structurée autour d'un ensemble d'atomes de carbone reliés ensembles par des liaisons simples ou multiples.
Ces atomes peuvent être liés de façon :
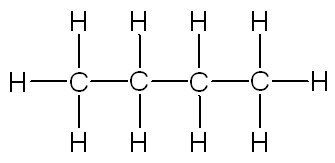
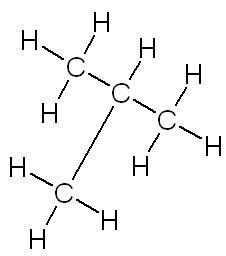
| linéaire | ramifiée | cyclique |
 |
 |
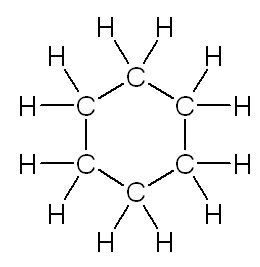 |
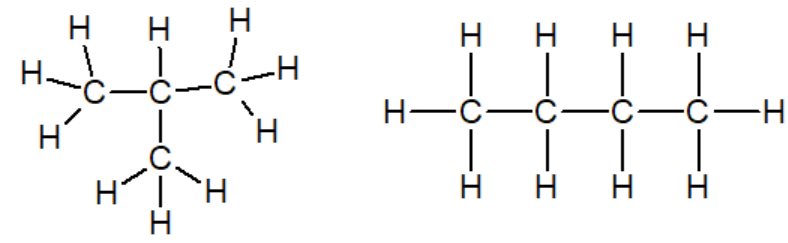
| butane | méthylpropane | cyclohexane |
Le préfixe indique le nombre d'atomes de carbone composant la chaîne principale :
| Nombre d'atomes de carbone | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ... |
| Préfixe | méth- | éth- | prop- | but- | pent- | hex- | hept | oct- | ... |
2) Les groupes fonctionnels⚓︎
A connaître
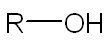
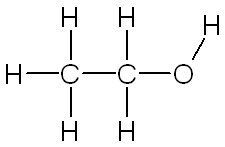
| Ethanol | Méthanol |
|---|---|
 |
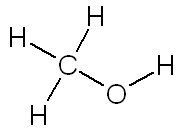 |
| C'est la molécule appelée couramment "alcool" dans le commerce. | C'est le plus simple des alcools, mais c'est un poison violent pour le foie. |
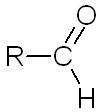
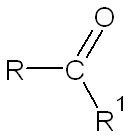
La molécule est dotée d'une liaison carbonyle \(C=O\). Elles peuvent être de types selon s'il s'agit un carbone terminal ou non
| Les aldéhydes | Les cétones |
|---|---|
 |
 |
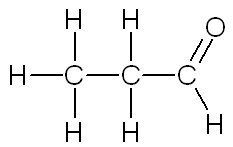
| Propanal | Propanone |
 |
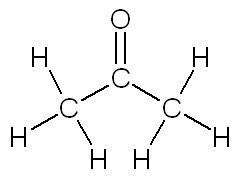 |
| Si l'atome de carbone auquel est rattaché l'atome d'oxygène n'est rattaché qu'à un seul autre carbone, c'est un aldéhyde. | Si l'atome de carbone auquel est rattaché l'atome d'oxygène est rattaché à deux autres carbones, c'est une cétone. |
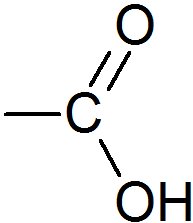
| Acide éthanoïque Acide acétique |
Acide méthanoïque Acide formique |
|---|---|
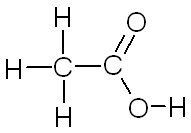 |
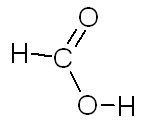 |
| C'est la molécule responsable de l'acidité du vinaigre. | C'est une molécule produite par certaines fourmis qu'elles projettent sur leur assaillant en cas d'agression. |
VI - Comment identifier une molécule ?⚓︎
1) La spectroscopie Infrarouge⚓︎
Rappel
Si une substance transparente apparaît colorée, c'est qu'elle ne transmet pas la totalité de la lumière qui l'éclaire.
Si le sulfate de cuivre CuSO4 a cette couleur bleu clair caractéristique, c'est qu'il absorbe une partie de la lumière rouge qui le traverse.
Principe
D'une façon générale toutes les molécules absorbent de la lumière à des longueur d'onde λ différentes. Ces longueurs d'onde ne sont pas nécessairement visibles et peuvent se situer soit dans le domaine infrarouge (IR), soit dans le domaine ultraviolet (UV).
Les liaisons présentes dans les molécules vibrent en permanence et peuvent par ce mécanisme absorber des rayonnements électromagnétiques de façon spécifique.
En réalisant le spectre IR en transmittance d'une molécule, on peut donc lister les liaisons qui la constitue et donc l'identifier.
Le spectre est tracé en fonction du nombre d'onde σ (cm-1) relié à la longueur d'onde λ par la relation
Vous aurez donc généralement un spectre joint à un tableau récapitulatif des zones d'absorption des différentes liaisons :
| Liaison | σ (cm-1) | Forme |
|---|---|---|
| O-H Libre | 3580-3650 | Bande fine |
| >O-H Lié | 3200-3400 | Bande large |
| C-H alcane | 2800-3100 | Plusieurs bandes |
| O-H acide carboxylique | 2500-3200 | Bande large |
| C=O aldéhyde et cétone | 1650-1730 | - |
| C=O acide carboxylique | 1680-1710 | - |
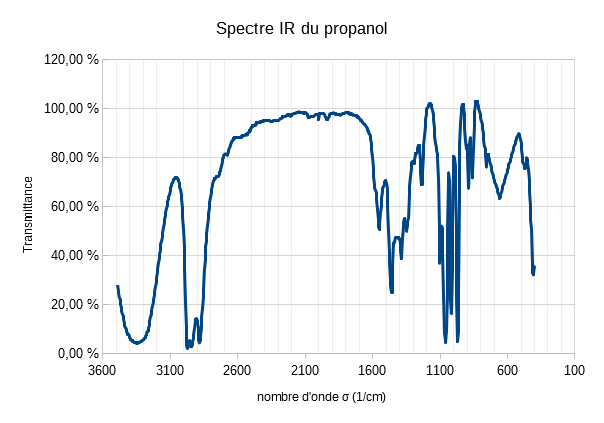
Récapitulatif
Une vidéo de la chaîne Les Bons Profs résume assez bien le cours
(attention, la vidéaste utilise le symbole nû tilde à la place de σ. On a )
lien video