Constitution et transformation de la matière
A. Détermination de la composition d'un système chimique⚓︎
1 - Mole et concentration molaire⚓︎
a) Une mesure du nombre d'atomes⚓︎
Jusqu'à présent, on assimile la "quantité" d'un produit en fonction de la mesure de son volume ("je prends 1,5L de soda") ou de sa masse ("Je prends 800g de champignons").
Pour les objets dénombrables, il est aussi possible d'en indiquer directement le nombre ("Je prends 3 croissants").
En chimie, s'il est relativement facile de prendre un volume ou une masse de substance donnée, on imagine qu'il est difficile de prendre un certain nombre d'atomes, car ceux-ci sont extrêmement petits et il est impossible de les compter un à un !
Il ne faut pas oublier que les Sciences Physiques ne fonctionnent jamais avec des mesures exactes, et qu'une connaissance approximative du nombre suffit.
 Par From a drawing by C. Sentier, executed in Torino at Litografia Doyen in 1856. — Edgar Fahs Smith collection , Domaine public, Lien |
Amadeo Avogadro est le premier à avoir tenté d'évaluer le nombre d'atomes présents dans une quantité de matière donnée.
La constante d'Avogadro NA est le nombre d'atomes de carbone 12 (12C) contenus dans 12 grammes de carbone 12.
NA = 6,02 x 1023 mol-1 Une mole d'objets est un "paquet" contenant 6,02 x 1023 objets.A partir de maintenant, une quantité de matière s'exprimera en moles. |
b) Une nouvelle concentration⚓︎
Définition
La concentration molaire d'une substance est donc la quantité de matière d'un soluté dissout contenu dans un volume V de solution :
| -n en moles (mol) -V en litres (L) -c en moles par litre (mol.L-1) |
2 - Détermination d'une quantité de matière⚓︎
a) Une mesure du nombre d'atomes⚓︎
N → n
On prélève ×10 atomes de __.
Cela représente ×10mol.
b) Masse molaire atomique⚓︎
La masse molaire atomique d'un atome est la masse d'une mole de cet atome pris à l'état naturel.
Elle est notée M et s'exprime en gramme par mole (g.mol-1).
Compte tenu de la façon dont la mole a été définie, il se trouve que la masse molaire d'un élément est approximativement égale au nombre de nucléons (protons+neutrons) qu'il contient.
Le nombre de masse indiqué dans le tableau de classification de votre livre représente ce nombre de nucléons, en prenant en compte que pour certains éléments (comme le cuivre MCu=63,5g.mol-1 ou le chlore MCl=35,5g.mol-1) existent sous plusieurs formes isotopiques. Leur masse molaire atomique est donc une moyenne prenant en compte l'importance de chaque isotope.
c) Masse molaire moléculaire⚓︎
La Masse molaire moléculaire d'une molécule correspond à la masse d'une mole de cette molécule.
Elle se calcule en faisant la somme des masses molaires atomiques des atomes qui composent cette molécule.
Exemple :
La molécule de saccharose C12H22O11 \(M_{C_{12} H_{22} O_{11}} = 12 \times M_C + 22 \times M_H + 11 \times M_O = 12 \times 12 + 22 \times 1 + 11 \times 16 = 342g.mol^{-1}\)
formule → M
a pour formule brute .
Sa masse molaire vaut donc M = g.mol-1.
d) Masse d'un échantillon et quantité de matière⚓︎
La masse m et la quantité de matière n d'un échantillon contenant une seule substance de masse molaire M se déduisent l'une de l'autre par les relations :
A savoir
|
et |
-n en moles (mol) -m en grammes (g) -M en grammes par mole (g.mol-1) |
Déterminer n
a pour formule brute et pour masse molaire M = g.mol-1.
g de contient donc ×10 mol de .
Déterminer m
a pour formule brute et pour masse molaire M = g.mol-1.
×10mol de a donc une masse de ×10 g.
Application
i. Déterminer la quantité de matière de saccharose (C12H22O11) contenue dans un sucre de 3g.
ii. Calculer la masse de sucre en poudre à peser pour prélever 0,15 mol de saccharose.
e) Concentration en masse et molaire⚓︎
La concentration en masse cm et la concentration molaire c d'une solution sont reliées par les relations :
A savoir
| et | -cm en grammes par litre (g.L-1) -c en moles par litre (mol.L-1) -M en grammes par mole (g.mol-1) |
Dissolution
On dissout une quantité n=×10mol de , de formule brute dans un volume de __ml d'eau.
La solution obtenue aura une concentration c=×10mol.L-1.
Prélèvement d'une quantité n
Quel volume d'une solution de de concentration c=×10mol.L-1 doit-on prélever pour avoir une quantité n=×10mol de ?
Il est nécessaire de prélever un volume V=mL.
f) Dilution et concentration⚓︎
| Lors d'une dilution la quantité de matière de soluté ne change pas. Cela nous permet donc d'écrire :
ou encore s'il s'agit de déterminer la concentration finale :
|
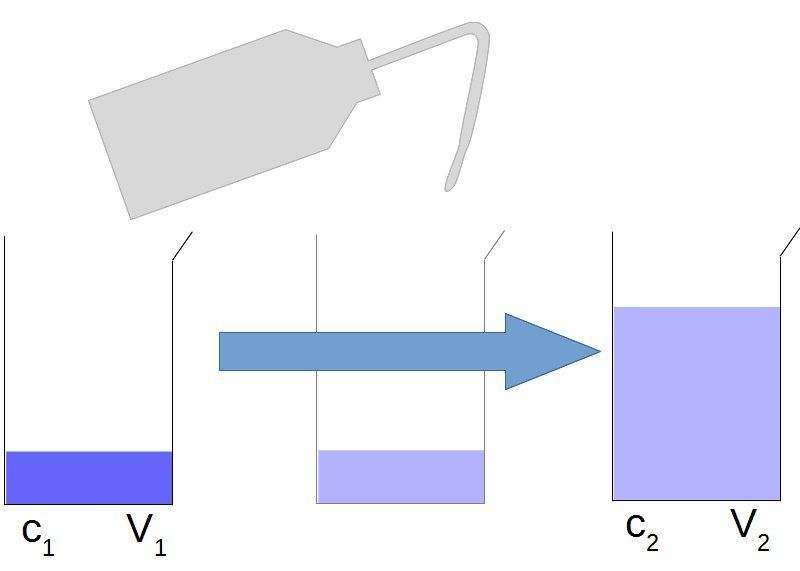 |
Calculer une dilution
On dispose dans le laboratoire d'une solution S0 de , de concentration C0=×10__mol.L-1.
Quel volume V0 de cette solution faudrait-il prélever pour préparer un volume V1=mL d'une solution S1 de concentration C1=×10__mol.L-1 ?
Il est nécessaire de prélever un volume V0=mL.
g) Volume molaire⚓︎
A savoir
Le volume molaire Vm est le volume occupé par 1 mole d'un gaz. Ce volume molaire dépend notamment de la pression et de la température de l'expérience mais aussi du type de gaz.
Pour le moment, vous devrez simplement faire le lien entre volume et quantité de matière.
Remarque : A température et pression standards (25°C, 1013hPa), le volume molaire de la plupart des gaz est de 24.8L.mol-1
n → V
Une bouteille de gaz de camping contient une masse m=g de de formule ___, de masse molaire M= __g.mol-1.
Quel volume occupera ce gaz s'il s'échappe de la bouteille ?
Donnée : Vm = ___ L.mol-1
Le volume occupé par le gaz échappé de la bouteille sera V=L.
3 - Couleur et concentration⚓︎
a) Pigments et colorants⚓︎
Différence
Les pigments sont des substances colorées présente dans un liquide dans lequel elles sont non solubles.
Les colorants sont des substances solubles dans le solvant utilisé.
& rarr; Si l'ont regarde avec un microscope une substance colorée par des pigments, il sera possible d'observer des grains de pigments, ce qui ne sera pas le cas pour une substance colorée par des colorants
Les pigments et colorants peuvent être naturels (l'espèce chimique est présente telle quelle dans la nature), synthétiques (elle peut être présente dans la nature, mais il est moins cher de la produire en laboratoire) ou artificiels (elle n'existe pas dans la nature).
Colorants et pigments ont un rôle central dans le monde actuel, car l'aspect visuel est un élément prépondérant pour nos achats, notre lieu de vie ou notre propre image !
Couleur d'une substance colorée
La couleur apparente d'une substance colorée s'explique à l'aide de la synthèse soustractive vue dans la partie précédente.
On devine facilement la couleur du sulfate de cuivre au regard de son spectre ci-dessus : puisque les longueurs d'ondes supérieures à celles du vert sont absorbées, il a nécessairement une couleur bleue probablement proche du cyan (car le vert est peut absorbé).
Le bleu vif E133 est plus étonnant car sa couleur est difficile à différencier à l'oeil nu du sulfate de cuivre alors que sont spectre d'absorbance pourrait nous indiquer une couleur davantage magenta.
Mélange de substances colorées
De même que pour la couleur d'une substance colorée, la couleur d'un mélange de substances à la condition qu'elles ne réagissent pas entre elles se déduit de la synthèse soustractive des couleurs.
De même, leur spectre d'absorbance sera la somme des 2 spectres individuels.
b) Absorbance⚓︎

Rappel : la lumière blanche naturelle est composée d'un spectre continu de longueurs d'ondes comprises entre 380nm et 780nm.
Une substance incolore laisse passer l'ensemble du spectre visible
A savoir
Une solution paraît colorée car elle absorbe une partie du spectre qui la traverse.
Un spectrophotomètre envoie une lumière blanche sur un échantillon de solution colorée et mesure pour chaque radiation la proportion de lumière ayant traversé l'échantillon
Transmittance & Absorbance
La transmittance T d'une solution est le rapport entre l'intensité d'une lumière monochromatique incidente et l'intensité de cette même lumière une fois qu'elle a traversé cette solution.
On utilise plus souvent l'absorbance A qui est lié à la transmittance par :
Si l'on réalise cette mesure sur tout un ensemble de longueurs d'onde, on obtient alors un spectre d'absorbance.
| Spectre du colorant E133 ("Bleu vif") | Spectre du Sulfate de cuivre |
|---|---|
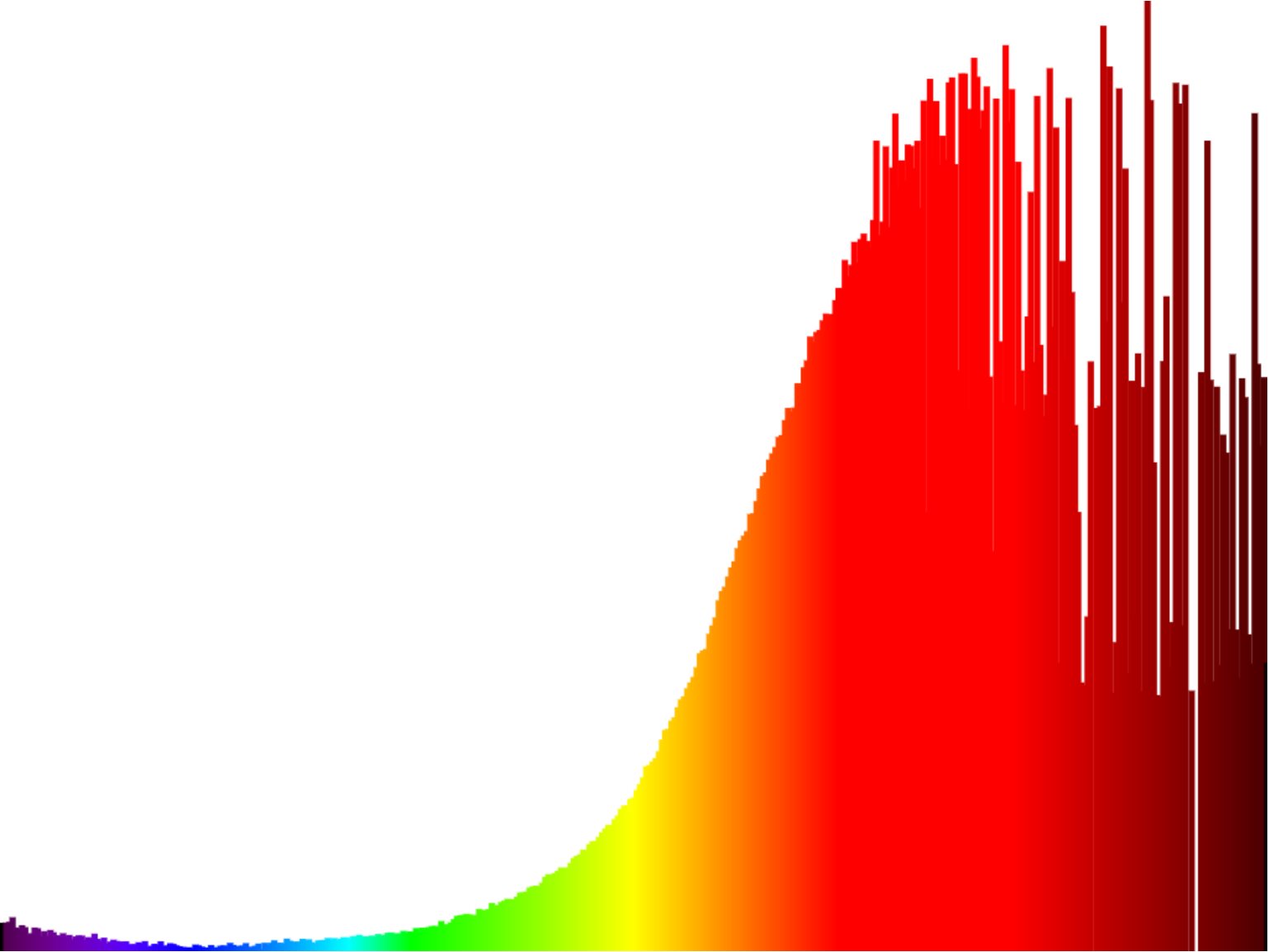 |
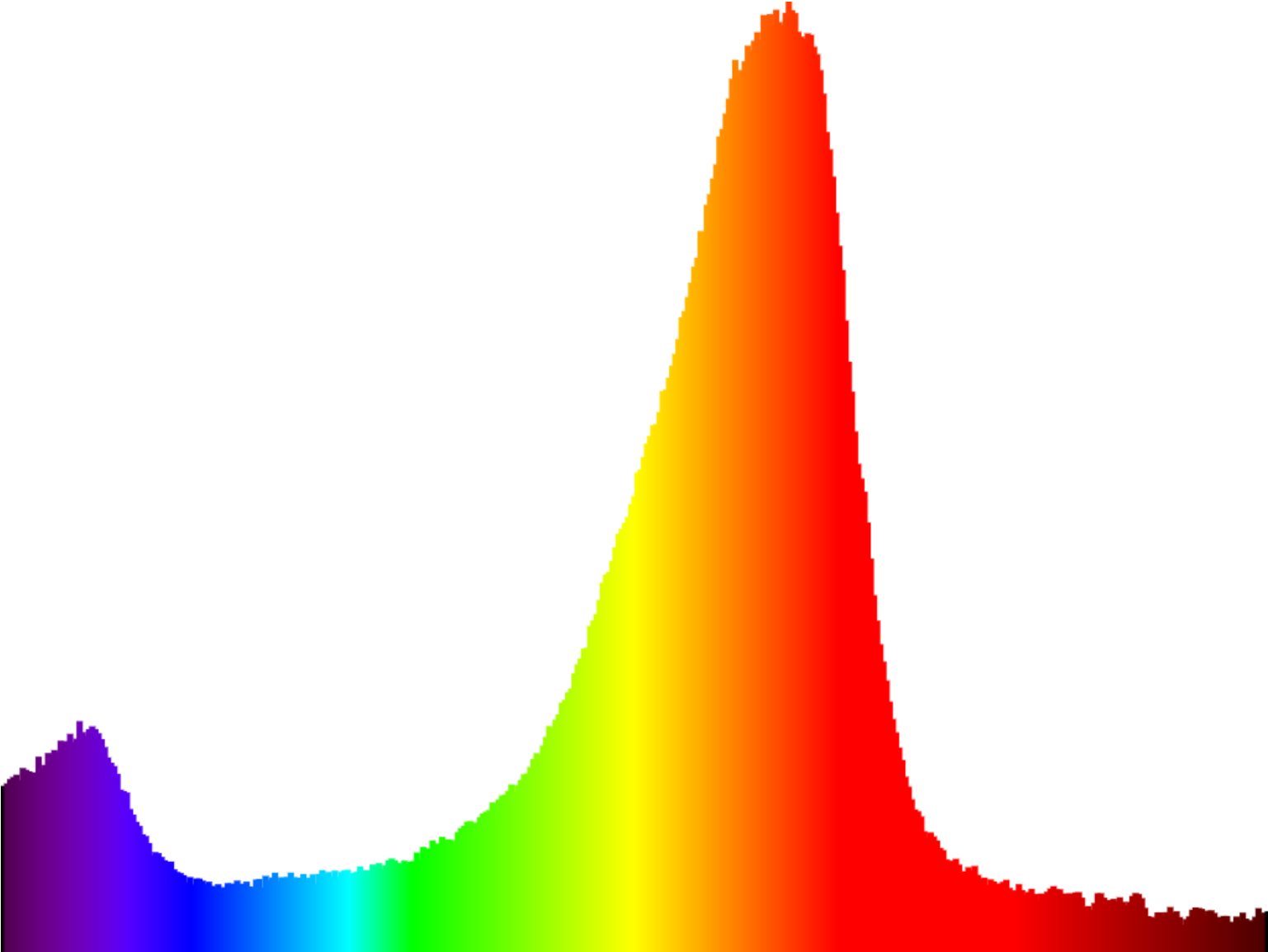 |
Echelle de teinte

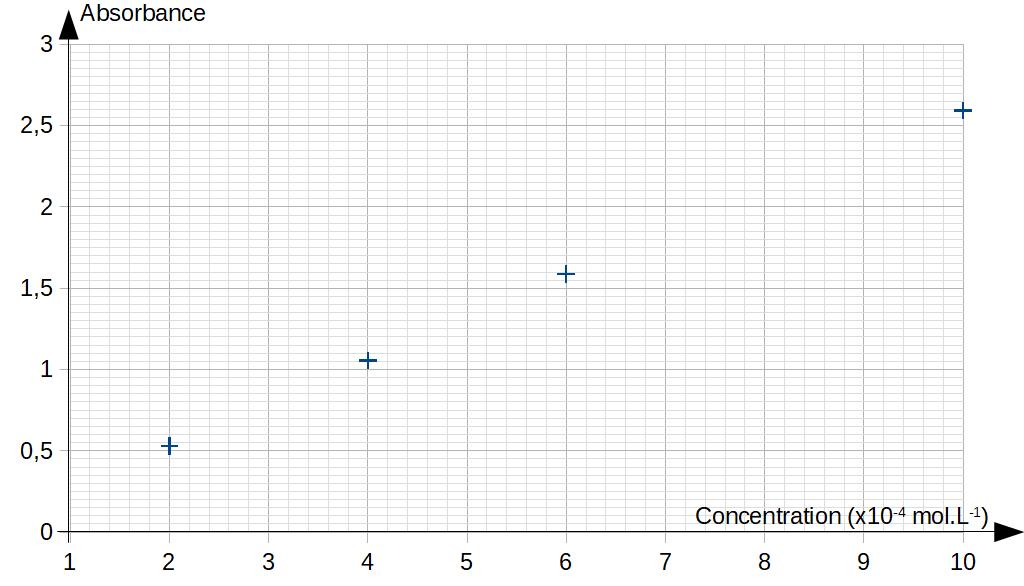
c) Loi de Beer-Lambert⚓︎
On imagine facilement que plus la concentration d'un produit coloré est importante, et plus la solution va paraître foncée. Il est donc possible d'encadrer la concentration d'une solution donnée en réalisant une échelle de teinte.
Cependant cette méthode n'est pas très précise, ni très rapide, car on doit préparer une solution intermédiaire à chaque fois que l'on souhaite augmenter le degré de précision de la mesure. De plus, notre oeil ne permettant pas de chiffrer l'intensité de la couleur, il n'est possible d'avoir qu'une évaluation qualitative (exemples : "plus foncé que" ou "moins foncé que") de la concentration.
En revanche, si l'on est capable de mesurer l'absorbance de la concentration, par exemple avec un
colorimètre, on va pouvoir essayer de trouver une relation mathématique entre la concentration d'une solution et sa capacité à absorber la lumière :
!!! note "Absorbance en fonction de la concentration
B. Suivi et modélisation de l’évolution d’un système chimique⚓︎
1- Réaction d'oxydo-réduction⚓︎
a) Expériences⚓︎
Expérience de l'arbre de Diane
Réaction de l'acide chlorhydrique sur les métaux
Si l'on prend une solution de sulfate de cuivre (Cu2+, SO42-) et que l'on y plonge un clou en fer, on va très rapidement observer un dépôt orange de cuivre autour du clou.
Si l'on remplace le clou par de la poudre de fer, celle-ci prendra une teinte rougeâtre, mais surtout la coloration bleue de la solution disparaîtra.
Enfin, un ajout de quelques gouttes de soude dans le filtrat de la solution précédente fera apparaître un précipité vert foncé d'hydroxyde de fer (II)
Rappel : tests caractéristiques
Le fer métallique Fe se transforme en ion fer (II) Fe2+ tandis que l'inverse se produit pour les ions cuivre (II) Cu2+ qui se transforment en cuivre métallique Cu.
Il est donc possible d'écrire l'équation de réaction :
b) Demi-équations et couples rédox⚓︎
L'expérience précédente montre que les ions Cu2+ sont capables de "voler" 2 électrons aux atomes de fer pour se transformer en atomes de cuivre.
Cu2+ et Cu forment ce qui s'appelle un couple oxydant/réducteur plus généralement appelé couple rédox, comme Fe2+ et Fe.
La demi-équation d'oxydoréduction permet de ne prendre en compte qu'un seul couple rédox mais surtout de faire apparaître les électrons e- non représentés dans les équations de transformation.
Ici on peut écrire :
Cu2+ + 2e- = Cu et Fe2+ + 2e- = Fe
On remarque par rapport à la transformation chimique qu'on a vue jusqu'à présent que le signe → est remplacé par le signe =.
En effet, en fonction des conditions, la réaction peut se faire dans un sens, ou dans l'autre.
couple oxydant/réducteur
Un couple rédox est constitué de deux espèces chimiques que l'on peut obtenir par gain (l'oxydant) ou perte (le réducteur) d'un ou plusieurs électrons.
La demi-équation d'oxydoréduction qui est liée est de la forme :
On peut également en cas de besoin équilibrer la réaction avec des espèces présentes dans la solution, comme H2O, H+ (milieu acide) ou HO- (milieu basique).
Par exemple, le couple permanganate/ion manganèse MnO4-/Mn2+ est un couple souvent utilisé en chimie. Utilisé en solution aqueuse il fait intervenir également de l'eau H2O et des ions H+ :
MnO4- + 8H+ + 5e- = 4H2O + Mn2+
c) Les piles⚓︎
Une réaction rédox fait donc intervenir un échange d'électrons entre 2 couples rédox, or les électrons sont les responsables du courant électrique dans les conducteurs métalliques et ne sont par ailleurs pas capables de circuler en solution aqueuse où seuls les ions circulent... serait-il possible de forcer les électrons à se déplacer à travers un circuit électrique avant d'atteindre l'oxydant ?
C'est le principe d'une pile, où les espèces censées réagir ensembles sont séparées dans des récipients différents.
Exemple de la pile Daniell
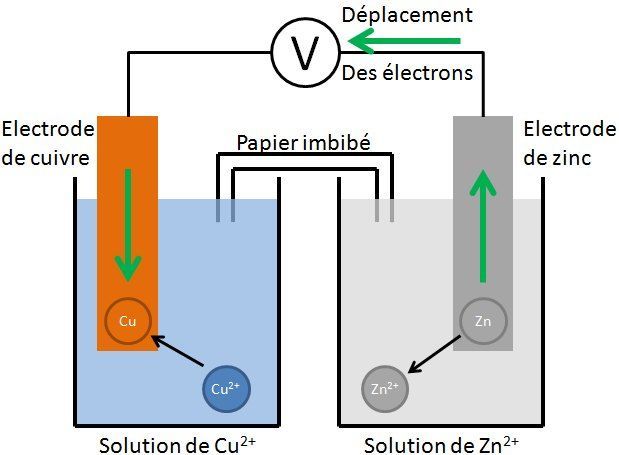
Cette pile a été créée en 1836 par John Daniell. Pour "obliger" les électrons à circuler dans le circuit électrique, on sépare la pile en 2 parties : l'une contenant les espèces cuivre et l'autre contenant les espèces zinc. Un papier imbibé d'électrolyte (l'eau du robinet peu suffire, mais on utilise plutôt du nitrate de potassium K+,NO3-) permet le passage des ions. Cette pile utilise la réaction Cu2+ + Zn → Zn2+ + Cu.
Le zinc (métal) disparaît donc pour se transformer en ions Zn2+. On dit que la pile « consomme » du zinc.
Lorsque la pile n’est pas branchée, les électrons ne peuvent pas circuler, la réaction n’a pas lieu. C’est pourquoi une pile ne s’use pas quand on ne l’utilise pas.
Les lames de métal sont appelées des des électrodes.
Sens commun et oxydoréduction
Il est assez courant d'entendre qu'il est possible de faire une pile avec une pomme de terre, un citron ou n'importe quel autre fruit. Le fruit n'y est pourtant pour rien !
Voici par exemple maintenant une expérience avec une demi-pomme et des lames de différents métaux :
On voit que ce qui fait la pile est le choix du métal et non le fruit qui se contente d'être une solution aqueuse dans laquelle les ions peuvent circuler.
D'ailleurs, on peut remplacer le fruit par un coton ou un mouchoir en papier humides !
(Youtube) Accumulateurs Lithium-ion
Une vidéo intéressante sur le principe de fonctionnement des accumulateurs lithium-ion, présents dans tous les objets électriques
Occurrence d'une réaction rédox
Une réaction d'oxydoréduction entre 2 couples rédox ox1/red1 et ox2/red2 ne peut avoir lieu qu'entre l'oxydant d'un couple et le réducteur de l'autre.
|
On pourra donc avoir : ox1 + red2 → ox2 + red1 ou ox2 + red1 → ox1 + red2 |
mais pas |
Remarque :
Il est possible de prévoir le sens de la réaction, mais cela n'est pas au programme de l'enseignement de spécialité en 1ère. Il vous suffira juste d'être attentifs aux informations présentes dans les documents !
d) équilibrer une réaction rédox⚓︎
Une transformation fait intervenir ox1 du couple ox1/red1 et red2 du couple ox2/red2, la transformation produit donc ox2 et red1.
Pour écrire l'équation modélisant la transformation chimique, on procède en 4 étapes :
- J'écris et j'équilibre les 2 demi-équations rédox :
a1.ox1+n1.e-+ ... = b1.red1 + ...
et
a2.ox2+n2.e-+ ... = b2.red2 + ... - Les demi-équations sont équilibrées individuellement. Le seul problème est que le nombre d'électrons e- échangés n'est pas le même (n1≠n2). On cherche donc le plus petit commun multiple de n1 et n2 et on multplie chaque ligne pour atteindre ce PPCM. Par défaut, on peut multplier la première demi-équation par n2 et la seconde par n1.
n2.a1.ox1+n2.n1.e-+ ... = n2.b1.red1 + ...
et
n1.a2.ox2+n1.n2.e-+ ... = n1.b2.red2 + ... - Ensuite on écrit l'équation qui le nécessite dans le "bon sens" (celui de la transformation) et on additionne les 2 équations :
n2.a1.ox1+n2.n1.e-+ ... = n2.b1.red1 + ...
mais
n1.b2.red2 + ... = n1.a2.ox2+n1.n2.e-+ ...
et donc :
n2.a1.ox1+n2.n1.e-+ ... + n1.b2.red2 + ... → n2.b1.red1 + ... +n1.a2.ox2+n1.n2.e-+ ... - Enfin, on "nettoie" l'équation en simplifiant l'écriture des substances éventuellement présentes des 2 côtés.
Exemple
On fait réagir du dioxyde de soufre SO2, réducteur du couple SO42-/SO2 avec l'ion permanganate MnO4-, oxydant du couple MnO4-/Mn2+.
Ecrire l'équation équilibrée de la transformation.
Voir le corrigé
On reprend la même démarche que précédemment :
-
J'écris et j'équilibre les demi-équations :
MnO4-+8H++5e- = Mn2++4H2O
et
SO42-+4H++2e- = SO2+2H2O -
Les 2 équations sont équilibrées individuellement mais le nombre d'électrons échangés (5 et 2) n'est pas le même. Le PPCM de 2 et 5 étant 10, on multiplie la première ligne par 2 et la seconde par 5
2×MnO4-+2×8H++2×5e-=2×Mn2++2×4H2O
soit
2MnO4-+16H++10e- = 2Mn2++8H2O
et
5×SO42-+5×4H++5×2e- = 5×SO2+5×2H2O soit
5SO42-+20H++10e- = 5SO2+10H2O - On écrit maintenant la seconde équation dans le sens de la réaction et on l'additionne avec la première :
2MnO4-+16H++10e-=2Mn2++8H2O
mais
5SO2+10H2O = 5SO42-+20H++10e-
Ce qui donne :
2MnO4-+16H++10e- + 5SO2+10H2O → 2Mn2++8H2O + 5SO42-+20H++10e- - Enfin, on "nettoie" l'équation des e-, H+ et H2O en excédent :
2MnO4-+ 5SO2+2H2O → 2Mn2++ 5SO42-+4H+
2- Notion d'avancement⚓︎
a) Métaphore culinaire⚓︎
Pour faire environ 15 crêpes, il faut :
- 2 oeufs
- 250g de farine
- un demi litre de lait
Il est possible d'écrire cette recette sous la forme d'une équation :
Imaginons maintenant que nous ayons à gérer le stock d'une cuisine et que nous souhaitions connaître le stock de chaque ingrédient restant en fonction du nombre de crêpes cuisinées. On peut l'écrire sous la forme d'un tableau :
| | | 2oeufs | + | 250g farine | + | 0.5L lait | → | 15 crêpes | |
| stock initial |
| | |
250 | | | |
10kg | | | |
20L | | | |
0 |
| 1 recette | | | |
250-2 =248 |
| | |
10000g-250 =9750 |
| | |
20-0.5=19.5 | | | |
15 |
| 3 recettes | | | |
250-3×2 =244 |
| | |
10000g-3×250 =9250 |
| | |
20-3×0.5 =18.5 |
| | |
3×15 =45 |
| x recettes | | | |
250-2x | | | |
10000g-250x | | | |
20-0.5x | | | |
15x |
| xmax recettes | | | |
250-2xmax | | | |
10000g-250xmax | | | |
20-0.5xmax | | | |
15xmax |
Pour pouvoir ensuite savoir combien de crêpes il va nous être possible de faire, il suffit de chercher le nombre de fois xmax qu'il va nous être possible de suivre la recette. Un simple calcul nous permet de voir que l'on peut suivre 125 fois la recette avec les oeufs, 40 fois avec la farine, et 40 fois avec le lait.
La farine et le lait seront limitants tandis qu'il restera des oeufs en excès. Au final on pourra répéter 40 fois la recette et donc préparer 40×15 = 600 crêpes. Bon appétit !
b) Avancement d'une réaction⚓︎
On peut tout à fait utiliser la métaphore précédente pour modéliser l'évolution des quantités de matières en réactifs et produits durant une transformation chimique : au fur est à mesure que la transformation s'accomplit, les quantités de réactifs décroissent et celles des produits augmentent.
Rappel :
Une transformation totale ne s'arrête qu'à l'épuisement d'un des réactifs
A savoir
L'avancement d'une réaction est une grandeur notée x qui s'exprime en moles.
Il correspond à la quantité de produit qui se formerait avec un coefficient stoechiométrique de 1.
A l'état final on note xmax la valeur de l'avancement maximal. On le détermine en cherchant le plus petit avancement pour lequel un des réactifs est totalement consommé
Application
On plonge un ruban de cuivre Cu de masse m=0.5g dans une solution de nitrate d'argent (Ag+,NO3-) de volume V=50mL et de concentration c=5.0×10-2mol.L-1.
Les ions Ag+ réagissent avec le cuivre pour former des ions cuivre(II) Cu2+ et de l'argent Ag.
Restera-t-il du cuivre à la fin de la réaction ?
Corrigé
- On commence par écrire l'équation de réaction :
2Ag+ + Cu → 2Ag + Cu2+ - On écrit ensuite le tableau d'avancement littéral
| 2Ag+ + Cu → Cu2+ + 2Ag x = 0 |
|nA |
|nB |
|0 |
|0 x = 0 |
|nA-2x |
|nB-x |
|x |
|2x xmax |
|nA-2xmax |
|nB-xmax |
|xmax |
|2xmax - On calcule ensuite les quantités intiales des différentes substances:
nA= c × V = 5.0×10-2×50×10-3 = 2.5×10-4mol. nB= m / MCu = 0.5 / 63.5 = 7.9×10-3mol. - On cherche ensuite le réactif limitant : celui pour lequel la valeur de xmax est la plus petite.
Si Ag+ est limitant : xmax1 = nA/2 = 1.25×10-4mol.
Si Cu est limitant : xmax2 = nB = 7.9×10-3mol.
Le réactif limitant est donc Ag+ car xmax1 < xmax2 et xmax = 1.25×10-4mol. - On peut maintenant compléter la dernière ligne du tableau avec les valeurs nupmériques :
| 2Ag+ + Cu → Cu2+ + 2Ag xmax |
|0 |
|7.9×10-3-1.25×10-4
=7.75×10-3|
|1.25×10-4 |
|2.5×10-4
Il reste donc une grande partie du cuivre intial en fin de réaction.
c) Dosage par titrage⚓︎
A savoir
Lorsque l'on souhaite déterminer la quantité de matière de substance dans une solution, on réalise un dosage. Si ce dosage fait intervenir une transformation chimique au cours de laquelle la substance à déterminer est consommée, on parle de dosage par titrage.
La substance titrée (ou réactif titré) est celle dont on souhaite connaître la quantité et la substance titrante (ou réactif titrant) est celle que l'on va ajouter.
Exemple
Il est courant d’introduire du dioxyde de soufre SO2 dans le vin pour réguler la fermentation et pour sa conservation, mais un excès de SO2 dans le vin peut provoquer des maux de tête. Sa concentration maximale autorisée est de 210 mg.L-1.
On souhaite réaliser le titrage d’un vin blanc par une solution de permanganate de potassium (K+(aq);MnO4−(aq)) en milieu acide pour vérifier sa concentration en SO2(aq).
L’équivalence est atteinte pour une couleur mauve persistante de la solution.
Données :
Solution de permanganate de potassium : cMnO4−=1,0×10−3mol.L-1;
Volume de vin blanc titré : Va =20,0 mL ;
Volume versé à l’équivalence : Veq =23,5 mL ;
Masses molaires :
M(SO2) = 64,1 g·mol-1,
M(KMnO4)=158 g·mol-1
Corrigé
Le hasard fait bien les choses, il s'agit précisément de la réaction vue plus haut.
L'équation support du titrage est donc :
2MnO4-+ 5SO2+2H2O → 2Mn2++ 5SO42-+4H+
- Je commence donc à réaliser le tableau d'avancement littéral :
|
|2MnO4- + 5SO2 + 2H2O → 2Mn2+ + 5SO42- + 4H+ x=0 |
|na |
|nb |
|/ |
|0 |
|0 |
|/ x |
|na-2x |
|nb-5x |
|/ |
|2x |
|5x |
|/ xmax=0 |
|na-2xmax |
|nb-5xmax |
|/ |
|2xmax |
|5xmax |
|/ - On devrait ensuite rechercher le réactif limitant sauf qu'on est en train de réaliser un dosage par titrage : c'est nous qui contrôlons la quantité de permanganate versé, que l'on arrête sitôt que la couleur mauve commence à persister.
On a donc au moment de l'équivalence versé le réactif titrant dans des proportions stoechiométriques : les 2 réactifs sont épuisés.
On a donc à la fois na-2xmax=0 et nb-5xmax=0.
De la première (celle que l'on connaît) on obtient xmax=na/2 et de la seconde (celle qu'on veut déterminer) nb= 5xmax.
En remplaçant dans la seconde la valeur de xmax trouvée dans la première, on trouve que nb=5na/2. - Il est maintenant possible de faire l'application numérique :
na= cMnO4- × Veq = 1.0×10-3 × 23.5×10-3 = 2.35×10-5mol.
nb=5na/2=5.88×10-5mol.
Il y a donc 5.88×10-5mol de dioxyde de soufre dans 20mL du vin blanc testé.
On calcule maintenant la masse de dioxyde de soufre correspondante :
mSO2=nb×MSO2 = 5.88×10-5 × 64.1 = 3.8×10-3g.
Cela correspond enfin à une concentration massique cm = mSO2 / Va = 3.8×10-3/(20×10-3) = 0.188g.L-1=188mg.L-1.
Le vin testé est donc réglementaire.
Exercices d'entraînement
d) avancement et modélisation informatique⚓︎
Il est possible d'utiliser un langage de programmation pour modéliser une transformation chimique.
Il ne vous est pas demandé de savoir le faire, mais en revanche, vous devez pouvoir interpréter un programme simple et éventuellement l'adapter.
Ouvrir le fichier TD06-1S_Spe_Python_et_avancement
Ouvrir le fichier Guide : comment tracer un graphique
Le programme peut se rédiger avec plusieurs niveaux de compétence, du simple tracé d'un graphique en fonction d'une situation déjà déterminée, jusqu'à un outil plus interactif permettant de s'adapter au nombre de substances et aux quantités de matières saisies par l'utilisateur.
Je vous propose ci-dessous 4 versions du programme, d'une version très basique jusqu'à la version 4, plus évoluée, mais dont l'étude se destine plutôt à des élèves suivant l'enseignement de spécialité NSI ou ayant des bases suffisantes en Python.
- Programme 01-basique : la quantité de chaque substance est définie par une fonction séparée
- Programme 02-avancé : le script peut prendre en compte un nombre arbitraire de substances
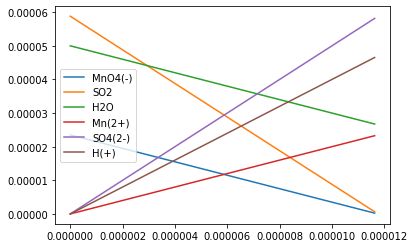
Quantités de matière en fonction de l'avancement x
dans le cas de l'exercice sur le dioxyde de soufre.Remarque : ce n'est pas l'objectif, mais il est possible d'aller (beaucoup) plus loin. L'inconvénient du dernier programme est par exemple de devoir définir une quantité de matière pour toutes les substances définies. Or il est parfois impossible de les déterminer lorsque l'exercice nous parle simplement de "réactif en excès" ou de "milieu aqueux acide" pour H2O et H+.Un autre programme possible peut construire un tableau d'avancement à partir d'une équation que vous définissez vous-même :
