B. Description et caractéristiques de la matière à l'échelle microscopique⚓︎
I- Constitution de l'atome⚓︎
1) Schéma⚓︎
Structure d'un atome
Note
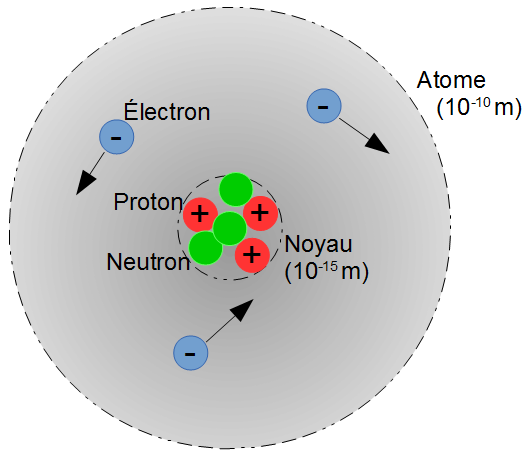
Un atome est composé d'électrons tournant autour d'un noyau.
- Dans le noyau se trouvent les protons et les neutrons : les nucléons
- Les protons possèdent une charge électrique positive :
1,6x10-19C (coulomb). - Les électrons possèdent une charge électrique négative :
** -1,6x10-19C (coulomb)**. - Les neutrons ne possèdent pas de charge électrique.
- Les protons et les neutrons ont à peu près la même masse :
mp ≃ mn = mnucléon = 1,67 × 10-27 kg. - Les électrons sont 1500 fois plus légers :
me = 9,1 × 10-31 kg.
2) Symbole du noyau⚓︎
Les atomes sont classés en fonctions de leurs propriétés chimiques. Or, ces propriétés sont liées au nombre de protons présents dans le noyau.
Neutralité électrique
Le nom d'un atome dépend uniquement du nombre de protons qu'il contient.
Si deux atomes ont le même nombre de protons mais un nombre de neutrons différent, ils sont dits isotopes du même élément.
Exemple
Le cuivre Cu est présent sous deux formes sur Terre, 63Cu contenant 34 neutrons et 65Cu avec 36 neutrons.
| Le noyau atomique est représenté par un symbole : | |
|---|---|
| Z : c'est le numéro atomique ou nombre de protons. | A : c'est le nombre de nucléons, appelé aussi nombre de masse. |
3) La classification périodique⚓︎
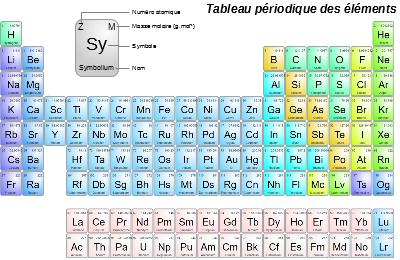
Classification périodique
La Classification périodique des éléments est un tableau classant l'ensemble des éléments chimiques existants.
L'intérêt de ce tableau est qu'il classe tout d'abord les éléments par numéro atomique Z croissant (c'est le nombre en haut à gauche dans la case).
Mais il les classe également par:
- groupe (les colonnes) : les éléments présents dans un même groupe ont des propriétés chimiques similaires,
- période (les lignes) : les éléments présents dans une même période ont le même nombre de couches électroniques.
Enfin, il indique une valeur appelée ici "masse atomique relative", que l'on retrouvera plus tard, mais qui pour le moment doit être considérée comme le le nombre de nucléons A de l'isotope majoritaire lorsque l'on arrondi ce nombre à l'unité.
4) Quelques exercices autour de l'atome⚓︎
Numéro atomique
Donner le numéro atomique de l'atome de ■■■.
Z=.
Score : 0/3
Z vers nom
Un atome porte le numéro atomique Z=■■■.
C'est donc un atome de : .
Score : 0/3
composition → A et Z
Un atome contient ■■■ protons et ■■■ neutrons.
Son numéro atomique Z vaut donc : et son nombre de nucléons : .
Score : 0/3
A et N → nom
Un atome contient ■■■ nucléons dont ■■■ neutrons.
C'est donc un atome de : et son symbole est :
Score : 0/3
Composition → masse
Calculez la masse d'un atome de ■■■■■■.
Sa masse est de : x10kg.
Score : 0/3
Masse → nom
Un atome contenant ■■■ neutrons a une masse de ■■■kg.
Sa représentation est donc :
Score : 0/3
Charge et masse → nom
Un atome a une masse de ■■■ kg, et son noyau a une charge électrique de ■■■C.
Sa représentation est donc :
Score : 0/3
II- Le cortège électronique⚓︎
Autour du noyau, les électrons se rangent en couches successives. A l'intérieur de ces couches, ils s'organisent en sous-couche
| sous-couche | |||||
| s | p | d | f | ||
| c o u c h e | 1 | 1s | |||
| 2 | 2s | 2p | 3 | 3s | 3p | 3d | 4 | 4s | 4p | 4d | 4f |
| 5 | 5s | 5p | 5d | 5f | |
Chaque sous-couche explique la position de l'élément dans le tableau périodique, comme le présente ce tableau, tiré de Wikipédia.
Règle de Klechkowski
Chaque couche peut stocker un nombre fixé d'électrons : 2 pour la couche s, 6 pour p, 10 pour d, 17 pour f.
Pour comprendre comment les couches se remplissent, il faut suivre la règle de klechkowski, où les couches se remplissent en "diagonale" :
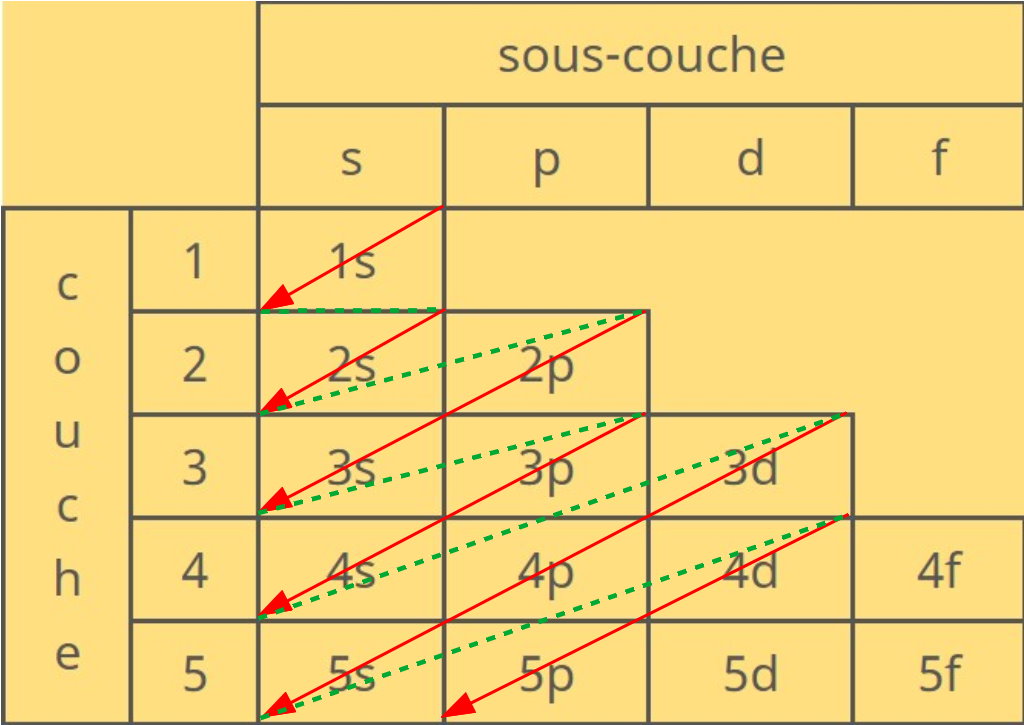
On a donc dans l'ordre les couches 1s, 2s, 3s, 3p, 4s, 3d, 4p, 5s, ...
III- Formation des ions monoatomiques⚓︎
Formation des ions
Un ion monoatomique est un atome qui a perdu ou gagné un ou plusieurs électrons.
- Un anion a gagné un ou plusieurs électrons et est donc chargé négativement.
exemple : F-, O2- - Un cation a perdu un ou plusieurs électrons et est donc chargé positivement.
exemple : Na+, Al3+
Les gaz nobles, une famille particulière⚓︎
Les éléments appartenant à la famille des gaz nobles ont la particularité d'être inertes : cela signifie qu'il ne
vont pas réaliser de réaction chimique.
Les réactions chimiques ayant pour origine la structure du cortège électronique et particulièrement sa couche externe, on en conclut
si les gaz nobles sont inertes, c'est que leur structure électronique de la forme s2 p6 est
particulièrement stable.
La conséquence est que si un autre élément vient à perdre ou gagner suffisamment d'électrons pour se retrouver dans une
structure similaire à celle d'un gaz noble, alors il la conservera et deviendra alors un ion, ce qu'il ne fera pas
avec une autre structure.
En résumé :
Un atome va donc avoir tendance à former un ion ayant la structure électronique du gaz noble le plus proche.
Exemple
- L'atome d'oxygène a un numéro atomique Z = 8, et la structure électronique 1s2 2s2 2p4.
Le gaz noble ayant la structure électronique la plus proche est le Néon avec 1s2 2s2 2p4.
⇒ L'atome d'oxygène va acquérir sa structure en capturant 2 électrons et en devenant l'ion O2-. - L'atome d'aluminium a un numéro atomique Z = 13, et la structure électronique 1s2 2s2 2p6 3s2 3p1.
Le gaz noble ayant la structure électronique la plus proche est le Néon avec 1s2 2s2 2p4.
⇒ L'atome d'aluminium va acquérir sa structure en libérant 3 électrons et en devenant l'ion Al3+.