Transformations de la matière
I - Les molécules et leur représentation⚓︎
Le cours en vidéo
1) le modèle moléculaire⚓︎
molécule d'aspirine
Ci-dessus, la représentation de la molécule d'aspirine.
En noir, les atomes de carbone ; en rouge, les atomes d'oxygène et en blanc les atomes d'hydrogène.
On remarque également que les "traits" représentant des liaisons covalentes entre les atomes sont plus ou moins épais : il s'agit de laisons simples ou de liaisons doubles.
Vous pouvez faire tourner la molécule sur elle-même en cliquant dessus et zoomer en utilisant la molette de la souris.
(désolé, le tactile n'est pas pris en charge !)
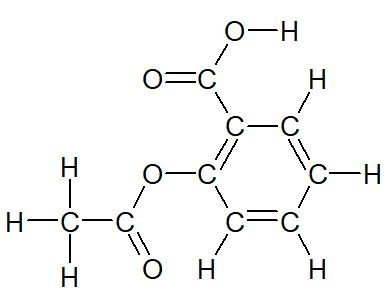
2) Formules développées et semi-développée⚓︎
Le modèle molécularie est utile lorsqu'il s'agit de manipuler la molécule, mais il est difficile à reproduire rapidement. Pour cette raison, on utilise en chimie 2 autres représentations :
La formule développée
Elle reprend le modèle moléculaire en remplaçant les boules colorées par le symbole de l'atome correspondant.
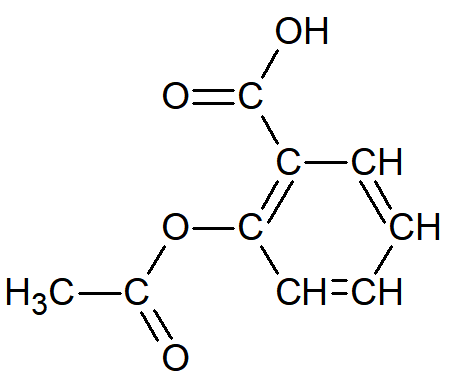
la formule semi-développée
La formule demi-développée simplifie la représentation en "collant" chaque atome d'hydrogène à l'atome auquel il est lié.
3) La formule brute⚓︎
La formule brute d'une molécule indique la nature des atomes qui la constituent et le nombre de chacun de ces atomes. Ce nombre est précisé en indice, droite du symbole de ces atomes.
Exemple
La molécule d'aspirine ci-dessus comporte 9 atomes de carbones, 4 atomes d'oxygène et 8 atomes d'hydrogène.
Sa formule brute est donc C9H8O4.
Remarque
Il est possible que 2 molécules aux structures différentes partagent la même formule brutes : elles sont isomères l'une de l'autre.
4) Les liaisons covalentes⚓︎
Elles correspondent à la mise en commun par deux atomes de deux électrons, chaque atome fournissant un électron.
Elle est schématisée par un trait :
Liaison simple
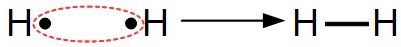
Deux atomes d'hydrogène vont mettre en commun leur électron pour créer une liaison covalente et former ainsi une molécule de dihydrogène H2 :
Liaison double

De même deux atomes d'oxygène mettront chacun deux électrons en commun pour former du dioxygène O2 :
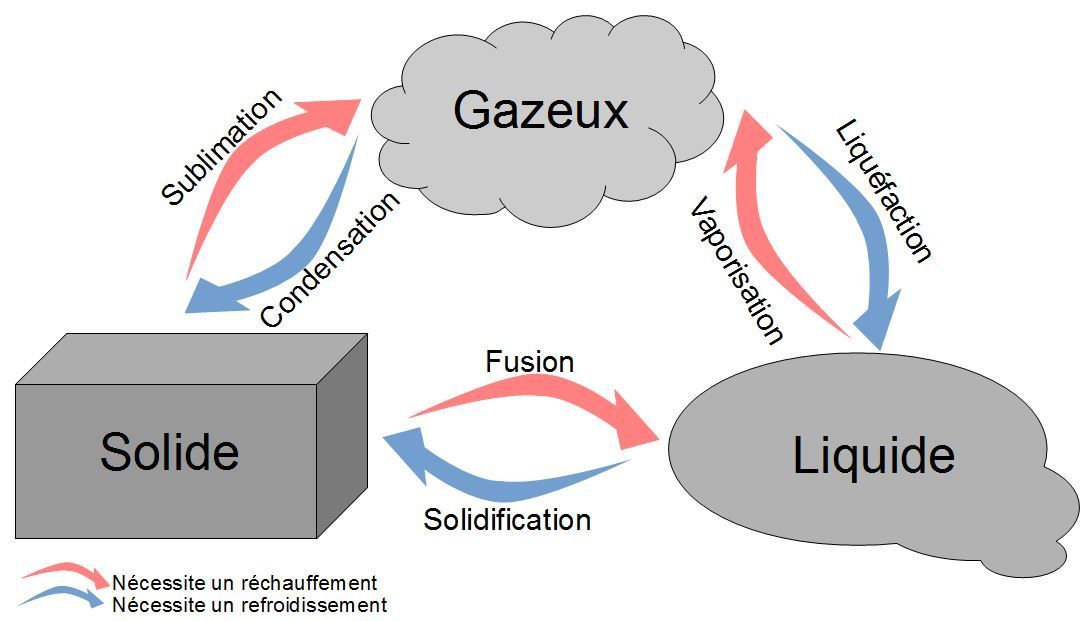
II - Transformations physiques⚓︎
Rappel
La matière existe sous différents états : solide, liquide ou gazeux. Le changement d'état correspond au passage d'un état à un autre.
A savoir
La température d'ébullition est la température à laquelle cette espèce passe de l'état liquide à l'état de gaz. Sous une pression donnée, l'ébullition d'un corps pur se fait à une température constante, caractéristique de ce corps.
Rappel
Ebullition de l'eau
On le voit sur la vidéo : la température augmente jusqu'à l'ébullition de l'eau, puis reste constante.
Cependant, on voit que la flamme continue de chauffer : elle continue donc de donner de l'énergie à l'eau. Toute cette énergie est utilisée pour transformer l'eau liquide en eau gazeuse (la vapeur d'eau).
III - Modéliser une transformation chimique⚓︎
1) La recette de cuisine⚓︎
Une pâte à crêpes
Pour réaliser une quinzaine de crêpes, il vous faudra :
- 250g de farine
- 0,5L de lait
- 3 oeufs
Cette recette courante reste compréhensible quand on l'écrit sous la forme :
250g farine + ½L lait + 3 oeufs → 15 crêpes
Vocabulaire
- Les coefficients en vert, que nous appelons proportions sont appelés coefficients stoechiométriques en chimie.
- Les ingrédients (à gauche) sont appelés réactifs.
- Les produits (à droite) sont appelés ... produits.
2) Application à la chimie⚓︎
Combustion
On fait brûler du méthane CH4 dans le dioxygène O2 de l'air.
La combustion produit du dioxyde de carbone CO2 et de l'eau H2O.
→ Ecrire l'équation de réaction correspondante.
Corrigé
On commence par écrire cette phrase sous la même forme que la recette de cuisine précédente :
méthane + dioxygène → dioxyde de carbone + eau
On l'écrit ensuite en utilisant les formules brutes :
CH4 + O2 → CO2 + H2O
Sous cette forme, on remarque qu'il n'y a pas le même nombre d'atomes d'hydrogène ou d'oxygène du côté des réactifs et des produits.
Le principe fondateur de la chimie moderne est la phrase célèbre d'Antoine de Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme"
Appliqué aux réactions chimiques, cela indique qu'il doit nécessairement y avoir autant d'atomes de chaque espèce du côté des réactifs et des produits.
Si ce n'est pas le cas, c'est soit que la "recette" de la transformation est incomplète, soit que les "proportions" ne sont pas les bonnes. On va donc ajouter les coefficients stoechiométriques nécessaires à la conservation de la matière :
CH4 + 2 O2 → CO2 + 2 H2O
Equilibrer une équation
Pour équilibrer une équation modélisant une transformation chimique :
- On écrit la réaction avec les formules brutes des substances, les réactifs à droite et les produits à gauche
- On ajuste les coefficients stoechiométriques si nécessaires, en commençant par les atomes qui n'apparaissent qu'une seule fois
Exercice 30p158 du livre
Ajuster les équations suivantes :
- CO(g) +O2(g) → CO2(g)
- I2(g)+SO42−(aq) → I−(aq)+S2O82−(aq)
- CO(g)+NO(g) → CO2(g)+N2
- CH3OH(l)+O2(g) → CO2g)+H2O(l)
- Al(s)+O2 → Al2O3
- C6H6(g) +O2 → CO2+H2O(l)
- Cu2+(aq)+Al(s) → Cu(s)+Al3+(aq)
- C7H8(g)+O2 → CO2 +H2O(l)
- CO(g)+NO2 → CO2+N2
- Fe3+(aq)+I-(aq) → I2(g)+Fe(s)
- NO3−(aq)+Fe2+(aq)+H+(aq) → NO(g)+H2O(l)+Fe3+(aq)
IV - Mole et quantité de matière⚓︎
1) Une mesure du nombre d'atomes⚓︎
Jusqu'à présent, on assimile la "quantité" d'un produit en fonction de la mesure de son volume ("je prends 1,5L de soda") ou de sa masse ("Je prends 800g de champignons").
Pour les objets dénombrables, il est aussi possible d'en indiquer directement le nombre ("Je prends 3 croissants").
En chimie, s'il est relativement facile de prendre un volume ou une masse de substance donnée, on imagine qu'il est difficile de prendre un certain nombre d'atomes, car ceux-ci sont extrêmement petits et il est impossible de les compter un à un !
Il ne faut pas oublier que les Sciences Physiques ne fonctionnent jamais avec des mesures exactes, et qu'une connaissance approximative du nombre suffit.

Amadeo Avogadro est le premier à avoir tenté d'évaluer le nombre d'atomes présents dans une quantité de matière donnée.
La constante d'Avogadro NA est le nombre d'atomes de carbone 12 (12C) contenus dans 12 grammes de carbone 12.
Une mole d'objets est un "paquet" contenant 6,02 x 1023 objets.
A partir de maintenant, une quantité de matière s'exprimera en moles.
2) Une mesure du nombre d'atomes⚓︎
nombre d'atomes → quantité de matière
On prélève ×10 atomes de __.
Cela représente ×10mol.
3) Masse molaire atomique⚓︎
A savoir
La masse molaire atomique d'un atome est la masse d'une mole de cet atome pris à l'état naturel.
Elle est notée M et s'exprime en gramme par mole (g.mol-1).
Masse molaire et classification périodique
Compte tenu de la façon dont la mole a été définie, il se trouve que la masse molaire d'un élément est approximativement égale au nombre de nucléons (protons+neutrons) qu'il contient.
Le nombre de masse indiqué dans le tableau de classification de votre livre représente ce nombre de nucléons, en prenant en compte que pour certains éléments (comme le cuivre MCu=63,5g.mol-1 ou le chlore MCl=35,5g.mol-1) existent sous plusieurs formes isotopiques. Leur masse molaire atomique est donc une moyenne prenant en compte l'importance de chaque isotop
d. Masse molaire moléculaire⚓︎
La Masse molaire moléculaire d'une molécule correspond à la masse d'une mole de cette molécule.
Elle se calcule en faisant la somme des masses molaires atomiques des atomes qui composent cette molécule.
Molécule de saccharose
La molécule de saccharose a pour formule brute C12H22O11
formule brute &rar;; M
a pour formule brute .
Sa masse molaire vaut donc M = g.mol-1.
5) Masse d'un échantillon et quantité de matière⚓︎
Relation entre m et n
Données
- n en moles (mol)
- m en grammes (g)
- M en grammes par mole (g.mol-1)
La masse m et la quantité de matière n d'un échantillon contenant une seule substance de masse molaire M se déduisent l'une de l'autre par les relations :
et
m → n
a pour formule brute et pour masse molaire M = __g.mol-1.
g de contient donc ×10 mol de __.
n → m
a pour formule brute et pour masse molaire M = __g.mol-1.
×10mol de __ a donc une masse de ×10 g.
Applications
- Déterminer la quantité de matière de saccharose (C12H22O11) contenue dans un sucre de 3g.
- Calculer la masse de sucre en poudre à peser pour prélever 0,15 mol de saccharose.
Corrigé
V - Synthèse d'une espèce chimique⚓︎
Définition
Synthétiser une espèce chimique consiste à fabriquer, à partir d'espèces chimiques de base, en effectuant des transformations chimiques qui comportent généralement plusieurs étapes, une nouvelle espèce chimique.
1) Différence naturel / synthèse⚓︎
Définition
Le terme chimique a pris une connotation négative. Cependant il faut prendre conscience que toutes les substances sont "chimiques".
Le terme chimique ne s'oppose pas au terme naturel.
Une molécule de synthèse est indiscernable de la même molécule d'origine naturelle.

Activité p164 du LivreScolaire "Pourquoi synthétiser ce qui existe déjà ?"
Corrigé
- La molécule naturelle extraite de la vanille est la vanilline, c'est elle qui peut être synthétisée "identique au naturel"
- L'éthylvanilline est la molécule de synthèse artificielle.
- Les deux molécules sont indiscernables l'une de l'autre. Elles sont identiques
- Les arômes de synthèse présentés dans le document sont des corps purs. La vanille en revanche contient de nombreux autre arômes, certes moins puissants, mais qui donneront un goût plus riche que la vanilline seule
2) Pourquoi synthétiser un produit ?⚓︎
- La molécule n'existe pas dans la nature
L'aspartame est une molécule ayant un pouvoir sucrant 150 fois supérieure à celle du saccharose (sucre en poudre). Elle est utilisée dans les "sucrettes" et n'a aucun pouvoir nutritionnel.
Très largement utilisée dans les boissons "light", elle a depuis été ciblée par une campagne de défiance. Le consensus scientifique va pourtant dans le sens de son innocuité. - une molécule naturelle existe, mais on veut améliorer ses propriétés
C'est le cas de l'aspirine, qui est une amélioration de l'acide salicylique présente dans l'écorce des saules (d'où son nom). Utilisée par les hommes depuis l'antiquité (et certains singes !) pour ses propriétés analgésiques, l'acide salicylique provoquait des douleurs à l'estomac. - Une molécule naturelle existe, mais il est plus économique de la synthétiser que de la cultiver.
C'est le cas de la vanilline.
3) Protocole opératoire⚓︎
Il sert de "recette" à la synthèse et précise :
- la nature et les quantités de réatifs et de solvants utilisés
- les règles de sécurité à respecter
- les montages réactionnels à utiliser
- l'ordre des étapes de séparation pour isoler la molécule fabriquée
- une étape de vérification de la nature de la molécule isolée (vérifier que l'on a bien isolé le produit que l'on voulait fabriquer !)
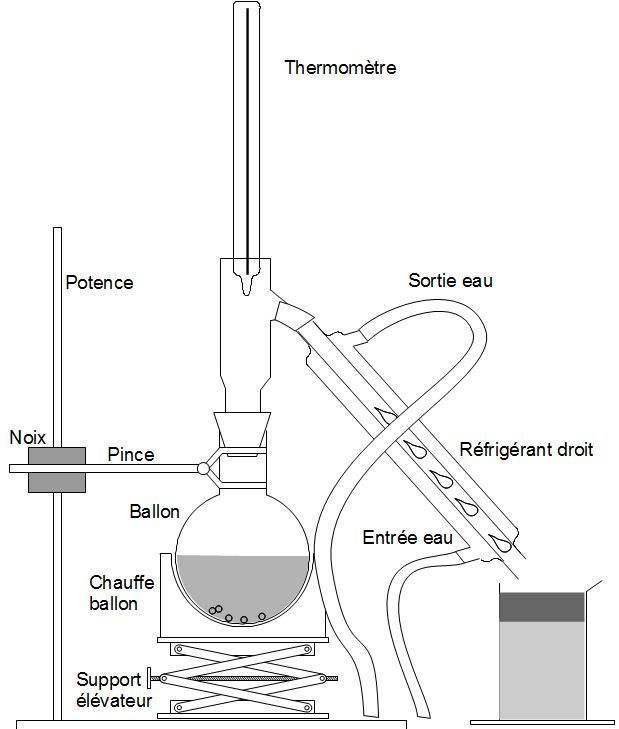
4) Exemples de montages réactionnels :⚓︎
| Entraînement à la vapeur | Chauffage à reflux |
|---|---|
 |
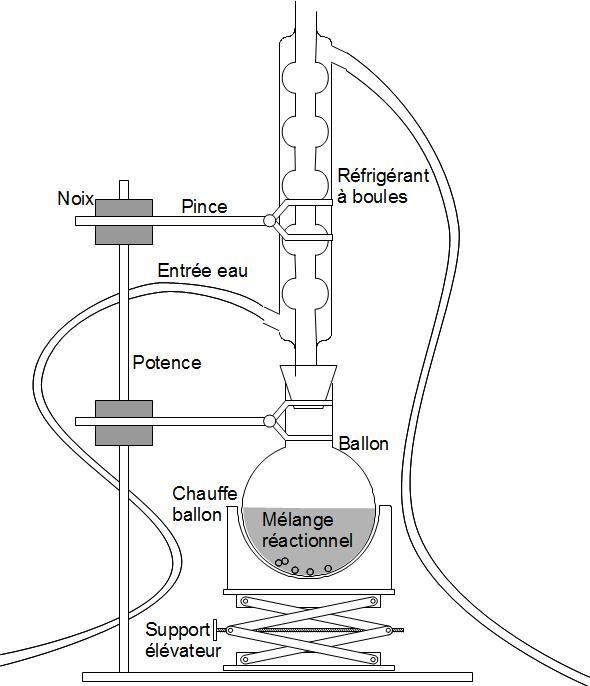 |
| Pour extraire un produit | Pour éviter les pertes de matière |
Question
Activité p165 du LivreScolaire "Synthèse de l'éthanoate d'isoamyle"
Corrigé
- L'équation de réaction est
acide éthanoïque + alcool isoamylique --> éthanoate d'isoamyle + eau
C2H4O2 + C5H12O --> C7H14O2 + H2O
On a bien autant d'atomes (7xC + 16xH + 3xO) de chaque espèces du côté des réactifs et des produits, l'équation est donc équilibrée -
Signification des pictogrammes
 indique que le produit est inflammable (ne pas le laisser à proximité d'une flamme ou d'une source de chaleur).
indique que le produit est inflammable (ne pas le laisser à proximité d'une flamme ou d'une source de chaleur). indique que le produit est corrosif : manipuler avec les protections adaptées (blouse, gants, lunettes).
indique que le produit est corrosif : manipuler avec les protections adaptées (blouse, gants, lunettes). indique que le produit est nocif : ne pas ingérer (évidemment), ne pas sentir, ne pas laisser au contact de la peau.
indique que le produit est nocif : ne pas ingérer (évidemment), ne pas sentir, ne pas laisser au contact de la peau.
-
Le chauffage à reflux (voir plus haut) est utilisé lorsque l'on souhaite conserver le produit dans le ballon : Quand on chauffe une substance jusqu'à l'ébullition, celle-ci se vaporise. Le produit quitte le ballon. En remontant le long du réfrigérant à boules, il entre au contact des parois, refroidies grâce à l'eau du robinet. La vapeur se liquéfie et retombe dans le ballon.
Ce montage est nécessaire dans notre TP car il évite les pertes de matière par évaporation, mais les vapeurs sont non seulement nocives mais également très odorantes.
Un groupe de TP qui a oublié de mettre en circulation l'eau dans son réfrigérant se "sent" très rapidement ! - On souhaite récupérer l'éthanoate d'isoamyle, sans les réactifs encore présents dans le ballon. On va donc essayer de le séparer de la solution aqueuse où se trouvent les autres produits.
On voit qu'il est très peu soluble dans l'eau salée : en ajoutant du sel, l'éthanoate d'isoamyle se séparera plus facilement de la solution aqueuse... mais restera mélangé à l'alcool isoamylique 
position des phases
(Youtube) Une vidéo montrant le montage tel qu'il pourrait être en TP.
Un jeune vidéaste présente très clairement la synthèse, à domicile. Il y a quelques erreurs mais c'est vraiment bien fait.

VI - Les transformations nucléaires⚓︎
1) Rappels⚓︎
Application
Un noyau possède 27 nucléons dont 14 neutrons. Représenter son symbole.
Corrigé
- Si le noyau possède 27 nucléons, alors A=27.
- S'il a 14 neutrons, alors il possède 27-14 = 13 protons.
- Le tableau de classification périodique nous indique qu'il s'agit de l'aluminium.
- Sa représentation est donc :
Isotopes
Si deux noyaux ont le même nombre de protons, mais un nombre de neutrons différent (donc même Z mais A différents), alors ils sont appelés isotopes d'un même élément.
Ex : Le carbone compte 3 isotopes : 12C (98,93% du carbone sur Terre), 13C (1,07% du carbone sur Terre) et 14C (radioactif et présent à l'état de traces).
2) La radioactivité⚓︎
La radioactivité
a. Définition⚓︎
Dans la nature, la plupart des noyaux sont stables, car l'interaction forte maintient dans le noyau les protons et les neutrons ensemble.
Cependant, certains noyaux comportant un trop grand nombre de protons par rapport aux neutrons, ou bien un trop grand nombre de neutrons par rapport aux protons voire une trop grande nombre de protons et de neutrons seront instables et se désintègreront spontanément en un nouveau noyau plus stable au bout d'un temps plus ou moins long en émettant un rayonnement sous forme de particules chargées et souvent, d'ondes électromagnétiques.
Cours
La radioactivité est la désintégration spontanée et aléatoire des noyaux atomiques instables en noyaux plus stables.
b. Un phénomène naturel⚓︎
Aux origines de l'Univers, les seuls noyaux qui existaient étaient des noyaux d'hydrogène et d'hélium.
Tous les autres éléments ont été fabriqués par les premières générations d'étoiles, fusionnant progressivement les noyaux d'hydrogène et d'hélium pour donner tous les éléments que nous connaissons actuellement.
Ainsi, nous sommes tous constitués d'atomes produits il y a des milliards d'années dans la fournaise d'une étoile qui a explosé...
Et on sait ça comment ?
On regardant les galaxies les plus éloignées, on remonte dans le temps. Nous voyons les plus anciennes galaxies découvertes telles qu'elles étaient lorsque l'Univers n'avait que quelques centaines de millions d'années.
Par spectrométrie, on peut constater que ces galaxies très anciennes ne comportent quasiment que de l'hydrogène et de l'hélium, ce qui veut dire que les autres éléments ont été créés après.
(Youtube) Une vidéo sur l'apparition de ces éléments

Les poussières et astéroïdes qui ont formés la Terre contenaient des éléments radioactifs et ce sont actuellement eux les principaux responsables de la radioactivité terrestre.
D'ailleurs, sans radioactivité naturelle, la Terre se serait refroidie depuis longtemps : c'est elle qui explique à l'heure actuelle la température du centre de la Terre (5300°C).
Conclusion
La radioactivité est donc essentiellement un phénomène naturel.
c. La radioactivité artificielle⚓︎
Depuis une centaine d'années, l'Homme est capable de fabriquer des noyaux radioactifs par collision de particules dans des accélérateurs : on parle alors de radioactivité artificielle.
Exemple
En médecine nucléaire on injecte au patient un isotope radioactif d'un élément inoffensif pour le corps, comme de l'iode 131.
L'isotope radiocatif ayant exactement les même propriétés chimiques que l'isotope stable, il ne peut être dangereux chimiquement pour le patient.
Grâce aux rayonnements émis par l'isotope radioactif lors de sa désintégration, on peut suivre son trajet dans le corps et donc s'assurer de la bonne santé du patient.
3) Transformations nucléaires naturelles⚓︎
Il est possible qu'un noyau se désintègre naturellement car le nombre de ses nucléons n'est pas "équilibré".
En effet, si un noyau comporte généralement davantage de neutrons que de protons, un excès de neutrons ou au contraire un déficit va rendre le noyau instable : il est alors possible qu'un proton se transforme spontanément en neutron ou inversement. On parle de radioactivité β
Il est également possible que le noyau soit simplement trop gros, et il se séparera d'un noyau d'4He, soit de 2 protons et 2 neutrons.
Ce qui donne :
| Nom : | particule | Condition | Equation |
| Alpha (α) |
noyau d'hélium 4 |
Le noyau contient trop de nucléons | |
| Bêta- (β-) |
Électron |
Le noyau comporte un excès de neutrons : l'un d'eux se transforme en proton | |
| Bêta+ (β+) |
Positron |
Le noyau comporte un excès de protons : l'un d'eux se transforme en neutron |
Remarques
- Le positron (ou positon) est l'antiparticule de l'électron
- L'antimatière n'est pas une imagination de science fiction : la physique actuelle prévoit que chaque type particule de matière ordinaire, possède son antiparticule, de même masse, mais de charge électrique opposée.
Ainsi le positron a une charge opposée à celle de l'électron et donc égale à celle d'un proton - En pratique ces réactions dégagent de l'énergie. Cette énergie se traduit par l'énergie cinétique des particules produites (elles se déplacent très vite) mais également par une émission d'ondes électromagnétiques dans le domaine gamma (γ)
- En étudiant l'énergie produite par la désintégration β les physiciens du début du XXèmes se rendent compte qu'il en "manque" : une partie de l'énergie semble diparaître lors de la désintégration !
Comme cela est contraire au principe de conservation de l'énergie, Wolfgang Ernst Pauli ne voit pas d'autre moyen que de supposer en 1931 l'existence d'une nouvelle particule, le neutrino de charge nulle et très difficile à détecter qui emporterait avec elle ce déficit d'énergie.
Bien que purement spéculative, cette particule finit par être découverte en 1956.
Comment savoir si le noyau est radioactif α, β+ ou β- ?
Il ne vous sera pas demandé de le deviner, cependant des diagrammes sont disponibles pour le savoir.
Par exemple, un petit programme que j'ai réalisé permet en cliquant sur un isotope instable de réaliser le "chemin" de désintégration jusqu'à un élément stable.
Activité et demi-vie
Spontanément les noyaux radioactifs vont se désintégrer. Comme si à chaque instant ils jouaient leur survie aux dés.
Définition
L'activité d'un échantillon contenant des noyaux radioactifs correspond au nombre de noyaux qui se désintègrent chaque seconde.
Elle s'exprime en bequerels (Bq).
=> voir l'exercice 22p192 du LivreScolaire
demi-vie du 14C
La demi-vie du carbone 14 est de 5730 ans.
=> Si un échantillon contient 1000 noyaux de 14C il n'en contiendra plus qu'environ 500 au bout de 5730 ans et 250 au bout de 11460 ans.
Un échantillon de matière peut contenir plusieurs milliards de noyaux radioactifs. De ce fait, le temps nécessaire à la désintégration totale des noyaux peut être extrêmement long et surtout dépend du nombre de noyaux au départ.
Pour caractériser la durée pendant laquelle un échantillon va rester radioactif, il nous faut une valeur indépendante de la taille de l'échantillon : la demi-vie.
Demi-vie
La demi-vie t1/2 est le temps au bout duquel la moitié des nouyaux radioactifs d'un échantillon s'est désintégrée.
Détermination de la demi-vie t1/2 d'un échantillon radioactif
Vous disposez d'une population de noyaux radioactifs de la taille que vous souhaitez. Chaque année, chacun des noyaux a une certaine probabilité (strictement comprise entre 0 et 1) de se désintégrer.
Encadrer expérimentalement la demi-vie t1/2 de votre échantillon.
Nombre initial (conseillé : 500-10000) :
Probabilité que le noyau se désintègre chaque année (conseillé : 0.05-0.3) :
Avec la probabilité choisie, la demi-vie de cette espèce est comprise entre ans ≤ demi-vie ≤ ans.