A. Description et caractéristiques de la matière à l'échelle macroscopique⚓︎
Exercices rappels conversions & notations
Convertir la grandeur donnée dans l'unité demandée
■■■ → ■■■
Score : 0/3
Convertir des durées
■■■h ■■■min ■■■s → s
Score : 0/3
Utiliser la notation scientifique
Convertir en notation scientifique :
■■■ = ×10.
Score : 0/3
Ecrire en notation décimale :
■■■×10■■■ = .
Score : 0/3
I - Corps purs et mélanges au quotidien⚓︎
1) Aspect visuel⚓︎
Ci-dessous, huit photos d'un verre contenant des liquides divers. Comment pourrions-nous les classer en deux catégories par simple observation ?
| 1 | 2 | 3 | 4 |
|---|---|---|---|
 |
 |
 |
 |
| 5 | 6 | 7 | 8 |
 |
 |
 |
 |
On voit que certains verres contiennent manifestement des mélanges : les photos 2, 3, 4. Pour les autres images, si le verre contient un mélange, il n'est pas visible.
Aspect visuel
On peut classer les mélanges en deux catégories selon leur aspect visuel :
- La catégorie des mélanges homogènes dont les constituants ne sont pas visibles à l'oeil nu
- La catégorie des mélanges hétérogènes qui regroupe les mélanges dont plusieurs constituants sont visibles à l'oeil nu.
Remarque :
Certains mélanges peuvent sembler homogènes de loin et hétérogènes de près (comme par exemple le jus d'orange, dont la pulpe est visible de près).
2) Mélanges et corps purs⚓︎
Définition
Un corps pur ne contient qu'une seule substance chimique.
Rappel :
Toutes les substances sont chimiques !
Parmi les exemples suivants, lesquels sont des corps purs ?

lait

eau en bouteille
 eau déminéralisée
eau déminéralisée
acétone

or 18 carats

or 24 carats

fourchette en inox

bicarbonate de soude

pâte à tartiner
Corrigé
Surpris du résultat ? Voici quelques éléments:
- Le lait est composé en grande majorité d'eau, mais il contient également de nombreux nutriments.
- L'eau de source, tout comme l'eau du robinet contient également des sels minéraux, c'est eux qui sont d'ailleurs responsables de son goût (si vous avez déjà bu de la Contrex, par exemple).
- L'eau déminéralisée peut être considérée comme un corps pur.
- L'acétone est un corps pur, de formule brute C3H6O.
- L'or 18 carats utilisé en bijouterie n'est pas pur ! 1 carat vaut 1/24 = 4.2%, un or pur (100%) est donc un or a 24 carats.
Pourquoi n'utilise-t-on pas d'or 24 carats ?
➔ parce que l'or est cher, mélanger l'or à d'autres métaux (principalement le cuivre et l'argent) permet de faire des économies,
➔ l'or est un métal "mou", le bijou est donc très fragile,
➔ les autres métaux ajoutés permettent de rendre le bijou plus solide. - L'inox est un alliage : c'est de l'acier (c'est-à-dire un mélange de fer et de carbone) auquel on a ajouté d'autres métaux. En effet, le fer rouille très facilement. Pour éviter que ce soit le cas avec l'inox, on ajoute généralement du chrome mais aussi du nickel. En regardant vos couverts chez vous, vous verrez peut-être la mention INOX 1810. Cela signifie que l'alliage de votre couvert est de l'acier mélangé à 18% de chrome et 10% de nickel.
- Le bicarbonate de soude est un produit alimentaire qui a de nombreuses utilisations (blanchir les dents, nettoyage des poêles, jus pétillants, ...) c'est un corps pur
- Pour la pâte à tartiner, la réponse est évidente :)
2 - Comment identifie-t-on une espèce chimique ?⚓︎
On peut caractériser une espèce chimique de différentes façons, que ce soit grâce à ses propriétés chimiques (réaction chimique avec une autre espèce) ou ses caractéristiques physique (masse volumique, température de changement d'état).
a) Masse volumique⚓︎
Définition
Données
ρ en kilogramme par mètre cube (kg.m-3)
m en kilogramme (kg)
V en mètres cube (m3)
La masse volumique ρ (prononcer "rhô") d'une espèce chimique s'obtient en divisant la masse m d'un échantillon de cette espèce par son volume V.
Remarque :
Même si le kg.m-3 est l'unité du Système International, il est courant en chimique d'utiliser d'autres unités, comme le kg.L-1, le g.L-1, ou le g.cm-1.
On passe facilement des unes aux autres en se rappelant que 1m3 = 1000L et que 1kg = 1000g.
On a donc : 1000 kg.m-3 = 1kg.L-1 = 1g.mL-1 = 1g.cm-3.
La masse volumique permet de distinguer 2 corps purs, cette valeur dépend des conditions de l'expérience, mais à température et pression ambiante, la valeur est généralement disponible sur Wikipédia.
Quelques masses volumiques de référence :
- air : 1.2 kg.m-3
- ethanol : 790 kg.m-3 = 790 g.L-1
- glace d'eau : 910 kg.m-3 = 910 g.L-1
- huile de tournesol : 920 kg.m-3 = 920 g.L-1
- eau : 1000 kg.m-3 = 1000 g.L-1 (définition initiale du kilogramme)
- aluminium : 2700 kg.m-3 = 2700 g.L-1
- fer : 7870 kg.m-3 = 7870 g.L-1
- cuivre : 8960 kg.m-3 = 8960 g.L-1
- plomb : 11350 kg.m-3 = 11350 g.L-1
- or : 21400 kg.m-3 = 21400 g.L-1
- osmium (métal le plus dense) : 22610 kg.m-3 = 22610 g.L-1
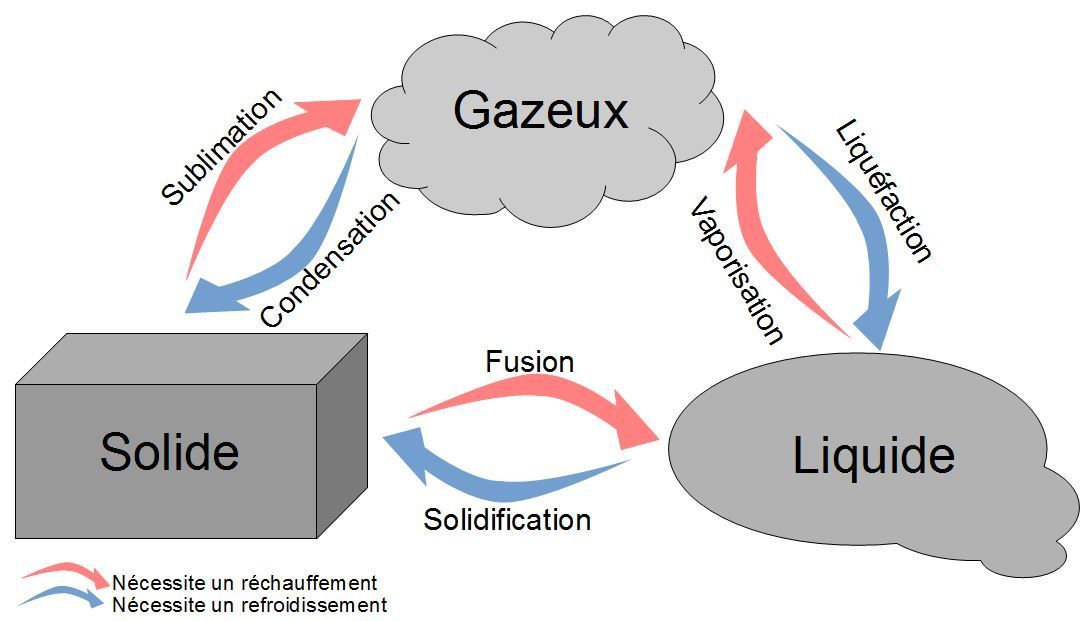
b) Température de changement d'état⚓︎
La matière existe sous différents états : solide, liquide ou gazeux.
Le changement d'état correspond au passage d'un état à un autre.
A savoir
La température d'ébullition est la température à laquelle cette espèce passe de l'état liquide à l'état de gaz.
Sous une pression donnée, l'ébullition d'un corps pur se fait à une température constante, caractéristique de ce corps.
De même, la température de fusion est la température à laquelle un corps pur passe de l'état liquide à l'état solide.
L'inverse n'est pas forcément vrai !
Il est possible de garder de l'eau liquide en-dessous de sa température de solidification. On parle alors de surfusion
Quelques températures de fusion de référence :
- azote : -219°C
- ethanol : -114°C
- mercure: -39°C
- eau : 0°C (définition initiale du degré centigrade)
- étain : 232°C
- plomb : 327°C
- aluminium : 660°C
- or : 1064°C
- fer : 1538°C
- tungstène : 3422°C
c) La chromatographie⚓︎
Le problème


Les colorants alimentaires utilisés en pâtisserie permettent d'obtenir n'importe quelle couleur en les mélangeant dans différentes proportions, en suivant les règles généralement indiquées à l'arrière de la boite.
Est-il possible de savoir si un colorant est pur ou bien s'il a été obtenu par un mélange de deux colorants différents ?
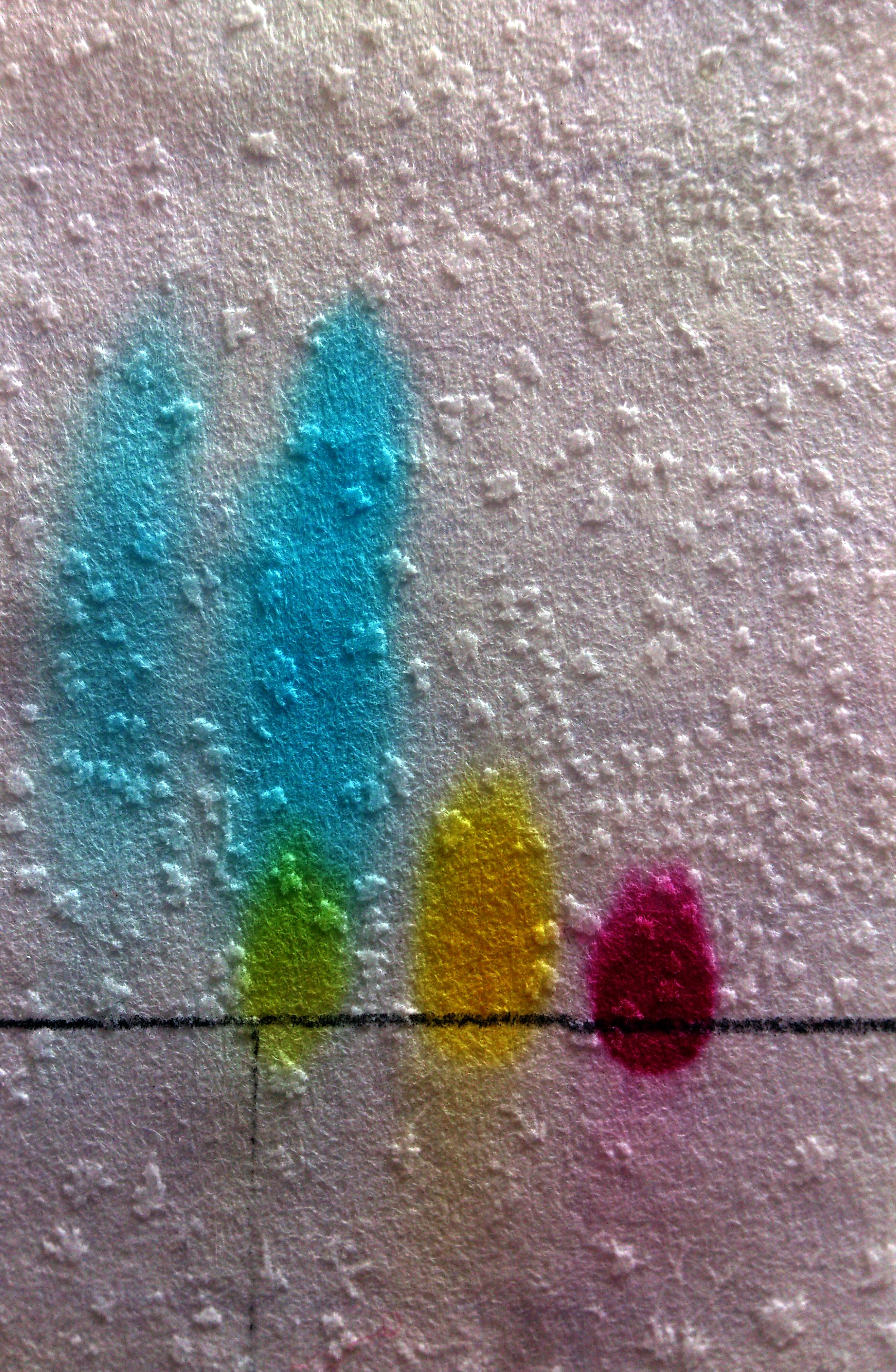
Un support sur lequel sont déposées les substances à étudier ou comparer a son extrémité trempée dans un solvant appelé éluant. L'éluant monte par capillarité le long du support et entraîne avec lui les substances étudiées à des "vitesses" qui leur sont propres. Si deux échatillons atteignent le même niveau, on peut considérer qu'ils sont constitués de la même substance chimique.
Il existe différentes méthodes de chromatographies. Elles sont couramment utilisées en laboratoire pour identifier certains composés et le procédé donne des résultats de qualité.
Nous avons réalisé une chromatographie sur couche mince, certes très grossière, mais qui nous permet de conclure sur la nature des colorants testés.
En effet, on voit sur la photo du résultat obtenu ci-contre que les taches de colorants bleu, jaune et rouge se sont déplacés le long du papier à des vitesses différentes. Le rouge n'a quasiment pas bougé, alors que le bleu a totalement quitté a ligne de dépôt.
Ces trois colorants se sont estompés, mais sont restés unis. En revanche dans le cas du colorant vert, la tache s'est dissociée en une tache bleue montant au même niveau que le colorant bleu et une tache jaune montant au même niveau que le colorant jaune.
Cela nous permet donc d'affirmer que non seulement le colorant vert est un mélange, mais qu'il a été obtenu en utilisant le colorant bleu et le colorant jaune que nous avons testés.
d) Les tests caractéristiques⚓︎
Il est possible de caractériser certains gaz à l'aide de leur propriétés chimiques :
Le dioxygène et le test de la bûchette incandescente.
Dans cette vidéo, le chimiste et vulgarisateur @brusicor02 vérifie grâce à ce test que le gaz produit est bien du dioxygène.
#LT (30/n)
Histoire de démontrer que c’est bien du dioxygène qui se dégage, j’ai refait l’expérience dans un tube à essai.
Approchons une bûchette incandescente et observons : la flamme se ravive, on a bien produit du dioxygène.— brusicor
Que se passe-t-il ?
Le dioxygène est le gaz dans l'air responsable de la combustion des matériaux (c'est un comburant). En son absence, la combustion ne peut pas avoir lieu (et donc la bûchette s'éteindrait) et inversement, elle va devenir plus vive en présence d'une source de dioxygène.
C'est exactement ce qu'il se passe ici : l'augmentation de la luminosité de la bûchette traduit la production de dioxygène par la réaction.
Le dihydrogène et le test de l'aboiement.
Dans cette vidéo, je fais réagir de l'acide chlorhydrique sur de la paille de fer. On peut deviner (la qualité de la vidéo trahit son âge) une effervescence dans le tube, caractéristique de la présence d'un gaz. en présentant une flamme de briquet à l'embouchure du tube, on voit une petite explosion accompagné d'un bruit sifflant, ressemblant à l'aboiement d'un chiot.
Que se passe-t-il ?
Le dihydrogène est un gaz extrêmement inflammable (c'est un combustible). Sa combustion est très rapide, tellement qu'elle va produire un bruit caractéristique que ne produit aucun autre gaz qui se consume. Ce sifflement, ou aboiement, est caractéristique du dihydrogène.
Le dioxyde de carbone et l'eau de chaux.
Dans cette vidéo, Nicolas Braneyre présente la réaction du dioxyde de carbone avec de l'eau de chaux et s'en sert pour montrer la présence de ce gaz dans les boissons pétillantes.
Que se passe-t-il ?
L'eau de chaux est une solution aqueuse saturée en hydroxyde de calcium [Ca2+,2HO-]. le dioxyde de carbone CO2 est très soluble dans l'eau et va réagir avec les ions Ca2+ pour donner du carbonate de calcium CaCO3. Cette espèce, très peu soluble dans l'eau va précipiter et former le voile blanchâtre dans la solution.
3 - Composition de l'air⚓︎
A savoir
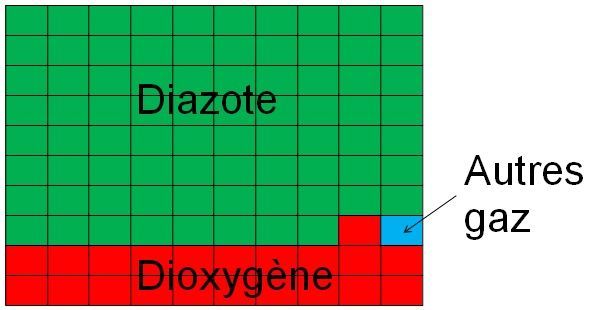
L'air est constitué de nombreux gaz, mais principalement d'environ : - 80% de diazote; - 20% de dioxygène.
Ce qui signifie en résumé que si l'air était représenté par ce tableau, la composition serait comme ci-contre.
Le carré bleu représente les autres gaz de l'atmosphère (principalement, l'argon), le dioxyde de carbone (0,0417%) ne serait qu'un petit point dans ce carré bleu.
Cela n'empêche pourtant en rien le dioxyde de carbone d'avoir l'impact sur l'effet de serre que l'on connaît. Il est d'ailleurs secondé par le méthane (0,00000184%) (Source)
II - Concentration en masse⚓︎
1) Définitions⚓︎
A savoir
Une solution est obtenue en dissolvant un soluté dans un solvant.
Exemple
Si vous mettez un sucre dans votre thé, au moment où vous touillez, le sucre se dissout dans l'eau chaude.
Dans cet exemple :
- l'eau est le solvant,
- le sucre est le soluté.
2) Une quantité par unité de volume⚓︎
Exercice 1 : dissolution
- Wydia dissout un sucre (saccharose) dans sa tasse de café (300mL).
Quelle serait la dose équivalente de sucre qu'elle devrait mettre dans une bouteille de 1L pour avoir le même goût ? - Une étiquette de soda indique "Quantité de sucre pour 1L : 106g".
Sachant qu'un morceau de sucre a une masse de 6g, calculer le nombre de morceaux dissout dans un verre (15cL) de ce soda. -
On souhaite préparer 50mL d'une solution sucrée de concentration en masse cm = 12,5g.
-
Déterminer la masse de sucre à peser
- Indiquer le protocole expérimental
Corrigé
- Il suffit d’utiliser la relation de proportionnalité :
Si 300mL contient 1 sucre alors 1L contient : - On commence par calculer la masse de sucre présente dans 15cL en utilisant la relation de proportionnalité :
On convertit maintenant cette masse en nombre de morceaux de sucre : - Les 2 parties :
- On commence par déterminer la masse de sucre présente dans 50mL en utilisant la proportionnalité :
- Protocole :
- Poser une coupelle sur une balance et faire la tare.
- Peser 0,625g de sucre.
- Verser dans une fiole jaugée de 50mL.
- Remplir d’eau distillée jusqu’à mi-hauteur.
- Boucher et agiter jusqu’à dissolution du sucre.
- Compléter en eau distillée jusqu’au trait de jauge.
- Boucher et retourner la fiole pour homogénéiser.
- On commence par déterminer la masse de sucre présente dans 50mL en utilisant la proportionnalité :
Exercice 2 : dilution
Yann verse 8g de sel dans son assiette de soupe (400mL).
- Calculer la concentration en masse de sel dans sa soupe en g.L-1.
- Pas de chance, elle est trop salée. Il ajoute une louche (200mL) de soupe et touille.
Calculer la nouvelle concentration en masse.
Corrigé
- Pour calculer la concentration en masse en g.L-1, il suffit à l’aide de la proportionnalité de déterminer quelle masse de sel serait présente dans 1L de soupe :
La concentration en masse de sel dans la soupe est donc de 20 g.L-1. - La soupe contient toujours 8g de sel mais a maintenant un volume de 600mL. En refaisant le calcul précédent :
La concentration en masse est donc maintenant de 13.3 g.L-1.
Concentration en masse
cm en grammes par litre (g.L-1)
m en grammes (g)
V en litres (L)
La concentration en masse cm d'une espèce chimique en solution s'obtient en divisant la masse m de cette espèce présente par le volume V de la solution.
Dissolution et concentration
On dissout une masse m=■■×10■■g de ■■, de formule brute ■■ dans un volume de ■■ml d'eau.
La solution obtenue aura une concentration cm=×10g.L-1.
Déterminer un volume à prélever
Quel volume d'une solution de ■■ de concentration cm=■■×10■■g.L-1 doit-on prélever pour avoir une masse m=■■×10■■g de ■■ ?
Il est nécessaire de prélever un volume V=mL.
3) Dilution et concentration en masse⚓︎
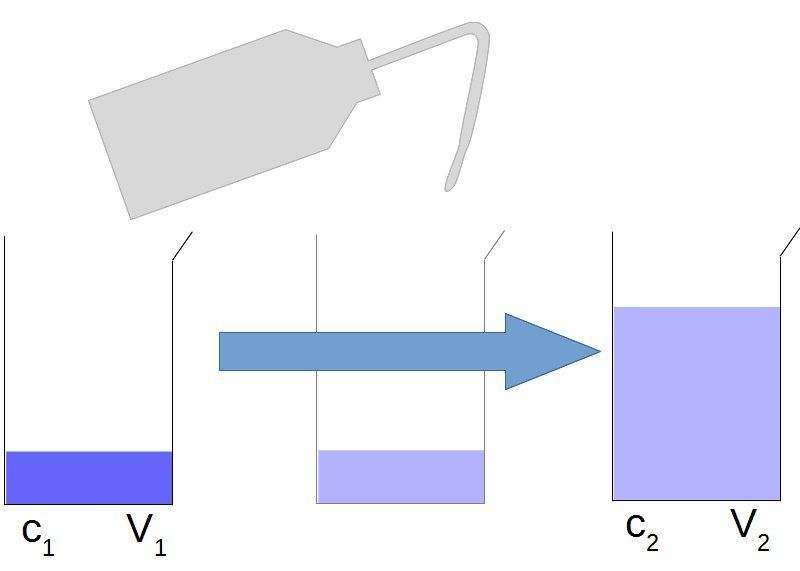
Lors d'une dilution la masse de soluté ne change pas. Cela nous permet donc d'écrire :
ou encore s'il s'agit de déterminer la concentration finale :
Préparer une solution-fille
On dispose dans le laboratoire d'une solution S0 de ■■, de concentration en masse cm0=■■×10■■g.L-1.
Quel volume V0 de cette solution faudrait-il prélever pour préparer un volume V1=■■mL d'une solution S1 de concentration cm1=■■×10■■g.L-1 ?
Il est nécessaire de prélever un volume V0=mL.
